Сульфур. Сірка
- 29-11-2023, 23:25
- 379
11 клас , Хімія 11 клас Григорович (рівень стандарту)
§ 20. Сульфур. Сірка
Сульфур
Сульфур — елемент 3 періоду VIA групи. Він є електронним аналогом Оксигену:
![]()
Завдяки цьому Сульфур реалізує валентність II та ступені окиснення -2 та +2. Але, на відміну від Оксигену, на зовнішньому рівні атомів Сульфуру є вільні d-орбіталі, які можуть брати участь у розпаруванні електронних пар під час переходу атома у збуджений стан. Унаслідок розпарування однієї електронної пари реалізується чотиривалентний стан Сульфуру і ступінь окиснення +4:
![]()
Унаслідок розпарування другої електронної пари реалізується шестивалентний стан і ступінь окиснення Сульфуру +6:
![]()
Для створення октету електронів на зовнішньому рівні атома Сульфуру не вистачає двох електронів, тому у сполуках із Гідрогеном і металічними елементами Сульфур виявляє нижчий ступінь окиснення -2:
S0 1s22s22p63s23p4 + 2e- → S-2 1s22s22p63s23p6
Під час взаємодії з неметалами, електронегативність яких більша за Сульфур (Флуор, Хлор, Бром та Оксиген), його атоми найчастіше віддають чотири валентні електрони:
S0 1s22s22p63s23p4 - 4e- → S+4 1s22s22p63s2
У разі втрати всіх шести валентних електронів Сульфур переходить у максимальний ступінь окиснення +6:
S0 1s22s22p63s23p4 - 6e- → S+6 1s22s22p6
Ступінь окиснення +2 не дуже поширений і виявляється лише в сполуках із Флуором SF2, Хлором SCl2 та Бромом SBr2.
Алотропні модифікації Сульфуру
Сульфур утворює три основні алотропні модифікації: ромбічна, моноклінна та пластична сірка. Вони відрізняються будовою молекул, формою кристалів і фізичними властивостями. За звичайних умов найстабільнішою є ромбічна сірка з молекулами S8, які нагадують корону (мал. 20.1). Назва цієї модифікації походить від форми її кристалів (мал. 20.2, а).
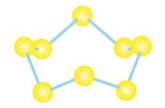
Мал. 20.1. Форма молекул сірки S8
Якщо ромбічну сірку розплавити та повільно охолодити, то з розплаву кристалізується моноклінна сірка. Вона також складається з молекул S8, але від ромбічної відрізняється формою кристалів (мал. 20.2, б).
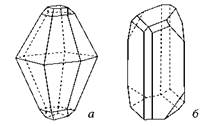
Мал. 20.2. Форма кристалів ромбічної (а) та моноклінної (б) сірки
Якщо розплавлену сірку нагріти, то в діапазоні 160-190 °С світло-жовта рідина чорніє, а циклічні молекули розриваються й об'єднуються в довгі ланцюги. За швидкого охолодження з такого розплаву утворюється третя алотропна модифікація — пластична сірка з формулою S∞. За звичайних умов із часом моноклінна та пластична модифікації перетворюються на ромбічну сірку. Під час кипіння довгі ланцюги пластичної сірки розриваються, і у випарах сірка існує у вигляді двохатомних молекул S2.
Сульфур утворює більш ніж десять алотропних модифікацій, що складаються з молекул S6, S7, S8, S20 тощо. Із них лише ромбічна сірка трапляється в природі.
Ромбічна сірка:
• світло-жовтий порошок або яскраво-жовті кристали з молекулярними кристалічними ґратками;
• крихка;
• нерозчинна у воді (мал. 20.3), розчиняється в органічних розчинниках (етанол, хлороформ, бензен тощо);
• густина 2,07 г/см3;
• tпл. = 112,8 °С, tкип. = 444,5 °С;
• стабільна за температури менше 95,4 °С.


Мал. 20.3. Хоча густина сірки більша за воду, але вона не змочується водою, тому порошкоподібна сірка не тоне у воді
Моноклінна сірка:
• темно-жовті голки з молекулярними кристалічними ґратками;
• крихка;
• нерозчинна у воді, розчиняється в неполярних органічних розчинниках (гексан, хлороформ, бензен тощо);
• густина 1,96 г/см3;
• tпл. = 119,3 °С, tкип. = 444,5 °С;
• стабільна за температури вище 95,4 °С, за меншої температури перетворюється на ромбічну сірку.

Пластична сірка:
• темно-коричнева або темно-жовта аморфна речовина;
• еластична, гумоподібна;
• нерозчинна;
• густина 1,92 г/см3;
• плавиться в діапазоні температур, tкип. = 445°С;
• нестабільна, протягом кількох годин стає крихкою і перетворюється на ромбічну.

Хімічні властивості сірки
Сірка — хімічно активна речовина, доволі сильний окисник, хоча виявляє і відновні властивості. Різні алотропні модифікації сірки не дуже відрізняються за хімічними властивостями, тому в рівняннях реакцій зазвичай не зазначають склад молекул сірки, а записують просто S.
1. Реакції з неметалами. За звичайних умов сірка малоактивна. Під час нагрівання вона вступає в реакцію з киснем і згоряє ледь помітним синім полум'ям (мал. 20.4, c. 106):
S + O2= SO2

Мал. 20.4. Горіння на повітрі сірки, що вилилася із жерла вулкана разом із лавою (вулкан Кава Іджен, Індонезія, вид уночі)
2. Реакції з металами. За підвищеної температури сірка реагує також із багатьма металами, утворюючи сульфіди:
• із лужними металами (під час сплавляння): S + 2Na = Na2S;
• з активними металами (за нагрівання): 3S + 2Al = Al2S3.
Застосування сірки
Щорічно у світі виробляється близько 50 млн тонн сірки. Більшу частину цієї кількості одержують під час очищення від сірки природного газу та нафти.
• Близько 90 % усієї добутої сірки йде на виробництво сульфатної кислоти (мал. 20.5, а).
• Сірку використовують у процесі вулканізації для перетворення каучуку на різні види гуми, а також для одержання органічних барвників, лікарських препаратів.
• Сірка є складовою пороху й інших піротехнічних сумішей (мал. 20.5, б).
• Сірчистим газом, що утворюється під час горіння сірки на повітрі, садівники навесні обкурюють плодові рослини (фруктові сади та теплиці) для знищення шкідників (мал. 20.5, в).
• Очищену сірку у вигляді мазей використовують для лікування захворювань шкіри.

Мал. 20.5. Застосування сірки: а — для виробництва сульфатної кислоти; б — для виготовлення пороху; в — для знищення садових шкідників
Поширеність та біологічне значення Сульфуру
Сульфур — досить поширений на Землі елемент, він становить 0,1 % маси земної кори (сьоме місце серед неметалічних елементів.)
На Землі існує багато покладів сірки. До того ж багато з них перебувають на поверхні, що дозволяє просто викопувати породу, а інші залягають на помірно невеликій глибині 200-500 м.
За розвіданими запасами сірки Україна посідає одне з перших місць у світі. Найбільші родовища сірки в Україні зосереджені переважно у Львівській та Івано-Франківській областях, але від кінця XX століття їх розробки призупинені або припинені внаслідок зменшення світового споживання сірки.
Сульфур міститься у складі багатьох речовин: у природі трапляється велика кількість сульфуровмісних сполук. Сульфідні руди містять багато цінних металічних елементів (мал. 20.6, а, б), тому ці руди є не лише джерелом Сульфуру, а й сировиною для добування металів. Також широко використовують сульфатні мінерали гіпс та алебастр (мал. 20.6, в, г).

Мал. 20.6. Природні сульфуровмісні мінерали: а — пірит FeS2; б — халькопірит CuFeS2; в — гіпс; г — алебастр
Сульфур — один із біогенних елементів. Він міститься у складі амінокислот (цистеїн та метіонін). Саме завдяки Сульфуру залишки цих амінокислот у молекулах білків беруть участь в утворенні дисульфідних містків, що стабілізують третинну структуру білка. Також Сульфур є у складі деяких вітамінів (біотин, тіамін) і ферментів. Організм людини містить близько 2 г Сульфуру на 1 кг маси тіла.
Ключова ідея
Сульфур — поширений у природі та важливий для існування життя елемент.
Контрольні запитання
281. Схарактеризуйте валентні стани та можливі ступені окиснення Сульфуру.
282. Порівняйте фізичні властивості різних алотропних модифікацій Сульфуру.
283. З якими речовинами сірка виявляє властивості окисника, а з якими — відновника?
284. Схарактеризуйте застосування сірки.
285. Схарактеризуйте поширеність та біологічне значення Сульфуру.
Завдання для засвоєння матеріалу
286. Взаємодія сірки з цинком відбувається так само, як і з алюмінієм. Складіть рівняння реакції та електронний баланс для цієї реакції.
287. Складіть рівняння реакцій утворення фосфор(ІІІ) сульфіду, натрій сульфіду, ферум(ІІІ) сульфіду з простих речовин. Укажіть окисник і відновник.
Комплексні завдання
288. У якій природній речовині масові частки Сульфуру й Оксигену однакові?
289. Визначте, у якій зі сполук — PbS, MnS, FeS, NiS, BaSO4 — масова частка Сульфуру найбільша, а в якій — найменша. Чи можна відповісти на це запитання без обчислень?
290. Скільки атомів Сульфуру міститься: а) у 2 моль цинкової обманки ZnS; б) у 0,1 моль мірабіліту Na2SO4 • 10H2O?
291. Обчисліть об'єм сульфур(IV) оксиду (н. у.), що утворюється під час спалювання сірки масою 80 г.
292. Змішали сірку й залізо масою по 56 г та прожарили. Обчисліть масу утвореної солі.
Завдання з розвитку критичного мислення
293. Як ви вважаєте, чому ромбічна та моноклінна сірки мають різні густини, різні температури плавлення, але однакову температуру кипіння?
294. Як можна схарактеризувати кристалічні ґратки пластичної сірки?
295. Як можна схарактеризувати розчинність пластичної сірки, ґрунтуючись на її будові?
Коментарі (0)