Необоротні та оборотні хімічні реакції
- 15-11-2023, 05:48
- 322
11 клас , Хімія 11 клас Попель, Крикля (рівень стандарту)
§ 9. Необоротні та оборотні хімічні реакції
Матеріал параграфа допоможе вам:
- пригадати класифікацію хімічних реакцій за напрямком перебігу;
- дізнатися про перетворення необоротної реакції на оборотну при зміні зовнішніх умов;
- зрозуміти, чому електролітична дисоціація кислоти є оборотним процесом, а дисоціація основи або солі — необоротним процесом.
Ви знаєте, що існують різні типи хімічних реакцій. Кожний спосіб їх класифікації ґрунтується на певній ознаці (наприклад, за кількістю реагентів і продуктів, наявністю чи відсутністю зміни ступенів окиснення елементів). Серед таких ознак — напрямок перебігу реакції.
Необоротні реакції. Вам відомі випадки, коли хімічних перетворень зазнають лише реагенти, а продукти реакцій не взаємодіють між собою. Такі реакції називають необоротними. Приклади реакцій, необоротних за будь-яких зовнішніх умов:
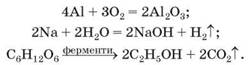
У рівнянні необоротної реакції між лівою і правою частинами записують знак рівності (=) або стрілку, спрямовану праворуч (→). Іноді кажуть, що така реакція проходить «зліва направо».
Оборотні реакції. Трапляється, що водночас із реакцією між реагентами взаємодіють її продукти (з утворенням реагентів), а в пробірці чи колбі в будь-який момент міститься суміш речовин — реагентів і продуктів.
Реакції, які одночасно відбуваються в протилежних напрямках, називають оборотними.
У рівнянні оборотної реакції використовують знак оборотності (⇄):
A + B ⇄ C + D.
Взаємодія речовин А і В є прямою реакцією, а речовин С і D — зворотною реакцією. Будьте уважними, не плутайте терміни «оборотна реакція» і «зворотна реакція».
Відомо багато оборотних реакцій. Серед них — взаємодія водню з парою йоду:
Н2 + І2 ⇄ 2НІ.

Пряма реакція відбувається при нагріванні й не завершується через одночасний перебіг зворотної реакції — розкладу гідроген йодиду на прості речовини. Досягти повної взаємодії водню з йодом не вдається, якщо підвищити температуру, збільшити тривалість досліду чи додати каталізатор. Аналогічну особливість має реакція водню з азотом, яку використовують у промисловості для добування амоніаку NH3:
3Н2 + N2 ⇄ 2NH3.
Оборотні реакції також відбуваються під час розчинення багатьох солей у воді (§ 12).
Деякі реакції є оборотними в певному інтервалі температур. Розглянемо приклад взаємоперетворення сполук Кальцію.
Кальцій оксид (технічна назва — негашене вапно) за звичайних умов дуже повільно реагує з вуглекислим газом і перетворюється на сіль — кальцій карбонат:
СаО + СО2 = СаСО3.
Тому негашене вапно зберігають у герметичній тарі; в іншому разі цей оксид взаємодіятиме з вуглекислим газом, який є в повітрі, й поступово перетвориться на карбонат. Вапно втратить властивості, які зумовлюють його використання на практиці.
Негашене вапно добувають нагріванням природного кальцій карбонату (вапняку, крейди) за температури 900 °С, тобто здійснюють протилежну реакцію:
![]()
За цих умов удається повністю перетворити сіль на оксид.
Цікаво знати
Оборотною в певному температурному інтервалі є реакція Са(ОН)2 ⇄ СаО + Н2О.
Якщо нагрівати кальцій карбонат у закритому реакторі при 900 °С, то розкладеться лише частина солі. У посудині виявимо суміш твердих сполук — СаО і СаСО3, а також вуглекислий газ. Отже, водночас відбуватимуться дві реакції — розкладу солі та сполучення оксидів. Маємо оборотну реакцію; розклад солі є прямою реакцією, а її утворення — зворотною:
СаСО3 ⇄ СаО + СО2.
Вивчаючи в 9 класі водні розчини, ви дізналися, що основи, кислоти, солі при розчиненні у воді розпадаються на йони. Цей процес називають електролітичною дисоціацією. Для кислот він є оборотним: частина молекул кислоти постійно розпадається на йони, а частина йонів сполучається в молекули:
НСl ⇄ Н+ + Сl-.
Електролітична дисоціація основ і солей є повною, тобто необоротним процесом. Це — йонні сполуки; їхні йони під час розчинення речовин переходять у розчин і не сполучаються один з одним:
Ba(OH)2 = Ва2+ + 2ОН-;
К3РО4 = 3К+ + РО3-4.
ВИСНОВКИ
Розрізняють оборотні та необоротні хімічні реакції. Оборотні реакції одночасно відбуваються у протилежних напрямках: взаємодіють між собою і реагенти (пряма реакція), і продукти (зворотна реакція). Необоротна реакція відбувається лише між реагентами, тобто в одному напрямку.
- 69. Оборотною чи необоротною є реакція:
а) обміну між двома солями в розчині;
б) горіння органічної речовини;
в) полімеризації етену?
Якщо реакція оборотна, то за будь-яких умов чи в певному інтервалі значень температури?
- 70. Однією з оборотних реакцій між органічними сполуками є реакція естерифікації. Напишіть рівняння реакції між метанолом та етановою кислотою. Яка реакція є прямою, а яка — зворотною?
- 71. До водного розчину натрій хлориду додають розбавлену нітратну кислоту. Чи взаємодіятимуть речовини? Якщо реакція відбувається, то оборотна чи необоротна? Відповідь аргументуйте.
- 72. Назвіть можливі причини неповного перетворення речовин під час необоротної хімічної реакції.
- 73. Наведіть приклад оборотної реакції кислотного оксиду з водою й напишіть відповідне хімічне рівняння.
- 74. Взаємодія водню з киснем за дуже високої температури є оборотною реакцією. Для експерименту взято вдвічі більший об’єм водню, ніж кисню. Із часом виявлено, що половина водяної пари, що утворилася, розклалася на прості речовини. Обчисліть відносну густину за повітрям відповідної суміші трьох газів.
Коментарі (0)