Будова та біологічна роль білків
- 30-07-2021, 21:56
- 1 134
10 Клас , Біологія і екологія 10 клас Остапченко (рівень стандарту)
§16. БУДОВА ТА БІОЛОГІЧНА РОЛЬ БІЛКІВ
Пригадайте, які сполуки називають органічними. Які елементи відносять до органогенних? Які речовини називають гідрофобними та гідрофільними? Як перебігають процеси денатурації та ренатурації білків, а як — деструкції? Які зв’язки називають ковалентними та водневими?
Органічні сполуки клітини. До складу будь-якої живої клітини входять органічні сполуки — білки, нуклеїнові кислоти, вуглеводи та ліпіди тощо. Серед них є біополімери, які складаються з мономерів.
Білки — високомолекулярні біополімери, мономерами яких є залишки амінокислот. Пригадаємо: амінокислоти — амфотерні органічні кислоти, що містять аміногрупу (-NH2) та карбоксильну групу (-СООН), зв’язані з одним і тим самим атомом Карбону (мал. 16.1). Амфотерні — означає, що залежно від умов вони можуть поводитися як кислота або основа.
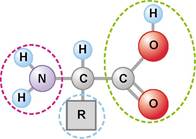
Мал. 16.1. Структура амінокислоти. Червоним пунктиром обведено аміногрупу, зеленим — карбоксильну групу, синім — радикал (бічна специфічна частина амінокислоти)
Запам'ятаємо
Амінокислоти, які кодуються генетичним кодом, називають стандартними, або протеїногенними.
З курсів біології та хімії 9 класу ви вже знаєте, що амінокислоти, здатні синтезуватися в організмі людини та тварин, називають замінними. Ті, що не утворюються в процесах обміну речовин, — незамінними. Їх синтезують рослини, гриби, мікроорганізми, і вони мають надходити до організму людини разом з їжею. Білки, які містять усі незамінні амінокислоти, називають повноцінними, на відміну від неповноцінних, що не містять окремих незамінних амінокислот. Відсутність або нестача навіть однієї незамінної амінокислоти може призвести до порушення біосинтезу білків, гальмування росту й розвитку організму.
Карбоксильна група однієї амінокислоти та аміногрупа іншої можуть вступати в хімічну реакцію, унаслідок якої вилучається молекула води та формується ковалентний зв’язок, який називають пептидним (мал. 16.2). Молекули, які складаються з великої кількості амінокислотних залишків (від 21 до 49), називають поліпептидами. Білки — це поліпептиди з високою молекулярною масою, які містять від 50 до кількох тисяч амінокислотних залишків.
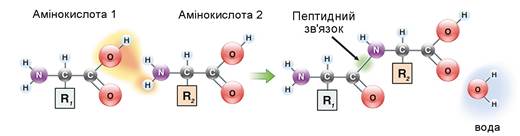
Мал. 16.2. Схема утворення пептидного зв’язку. Завдання: за схемою поясніть, як формується пептидний зв’язок
Існують чотири основні рівні структурної організації (конформації) білків: первинний, вторинний, третинний та четвертинний (пригадайте механізм їхнього утворення).
Глобулярні білки (мал. 16.3, 1) мають більш або менш сферичну форму й водорозчинні. До глобулярних білків належать ферменти, імуноглобуліни (антитіла), деякі гормони (як-от, інсулін) тощо. Натомість фібрилярні білки (мал. 16.3, 2) складаються з видовжених паралельно розташованих поліпептидних ланцюгів або довгих ділянок регулярної вторинної структури. Вони входять до складу кісток і сполучних тканин, волосся тощо. Більшість таких білків у воді не розчиняються, мають велику молекулярну масу. До складу клітинних мембран входять мембранні білки (мал. 16.3, 3). Вони виконують функцію клітинних рецепторів, беруть участь у транспорті речовин через клітинні мембрани.
За хімічним складом білки поділяють на прості, або протеїни (складаються лише з амінокислотних залишків), та складні, або протеїди, як-от глікопротеїди, що містять залишки вуглеводів, нуклеопротеїди, що містять залишки нуклеїнових кислот, ліпопротеїди містять залишки ліпідів.
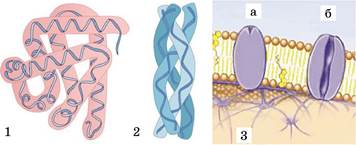
Мал. 16.3. Різні структурні класи білків: 1 — глобулярні, 2 — фібрилярні, 3 — мембранні: а — рецепторний білок; б — транспортний білок. Завдання: поясніть, як пов’язані між собою будова білкових молекул та їхні функції
Біологічна роль білків надзвичайно різноманітна. Найважливішою є їхня каталітична функція, яку виконують особливі білки - ферменти (або ензими). Роль ферментів — прискорення біохімічних реакцій. На перебіг реакції треба витратити певну енергію, яка потім компенсується за рахунок утворення нового зв’язку в складі продуктів реакції. Значне підвищення температури, а відповідно, кінетичної енергії руху молекул, яке могло б допомогти подолати цей енергетичний бар’єр, неможливе в живій клітині: підвищення температури спричиняє денатурацію білків та інших біополімерів. Натомість фермент, утворюючи проміжний комплекс із речовинами, що вступають у реакцію, жорстко фіксує їх у певній взаємній орієнтації. Це знижує енергію активації — мінімальну енергію, потрібну для здійснення реакції (мал. 16.4). У результаті проміжний комплекс швидко розпадається з утворенням продуктів реакції. Сам фермент при цьому не втрачає своєї структури, а отже, й активності, і може каталізувати наступну подібну реакцію. Крім того, у результаті ферментативних реакцій, на відміну від безферментних, не утворюються побічні продукти.
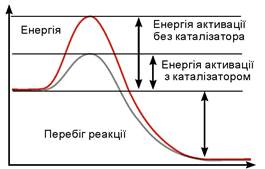
Мал. 16.4. Графік, який ілюструє, як фермент знижує енергію активації
Каталітична активність ферменту зумовлена не всією його молекулою, а лише її невеликою ділянкою — активним центром. Структура активного центру має відповідати просторовій структурі сполук, які вступають у реакцію. В одній молекулі ферменту може бути кілька активних центрів. Такі ферменти здатні прискорювати відповідну кількість подібних реакцій.
Цікаво знати
У 1890 р. німецький біохімік Еміль Герман Фішер (1852—1919) запропонував модель, що пояснює специфічність ферментів. Її назвали модель «ключ-замок». Згодом було встановлено, що ферменти не жорсткі, а гнучкі молекули: конформація активного центру може дещо змінюватися після зв’язування субстрату, а в деяких випадках може змінюватись і конформація самого субстрату. Така модель дістала назву «рука-рукавичка».
Часто до складу активного центру входять зв’язані з білком небілкові компоненти — кофактори. Ними можуть бути йони металів або порівняно невеликі органічні молекули — коферменти, наприклад похідні вітамінів. Ферменти, до складу яких входять кофактори, називають складними (як-от, ДНК-полімераза, коферментом у складі якої є йони Магнію), на відміну від простих ферментів (таких як пепсин, трипсин тощо), що містять тільки білковий компонент. Білковий компонент складних ферментів називають апоферментом. Активність складних ферментів проявляється лише тоді, коли апофермент зв’язується з кофактором.
За кілька секунд чи навіть частки секунди в організмі відбувається складна послідовність реакцій, кожна з яких потребує свого специфічного ферменту. Одні з ферментів прискорюють розщеплення органічних сполук на простіші, інші — реакції біосинтезу. Ланцюги взаємопов’язаних ферментативних реакцій загалом забезпечують обмін речовин і перетворення енергії в окремих клітинах й організмі в цілому.
Функції білків. Будівельна функція. Білки є складовою частиною біологічних мембран, хромосом, з білків складаються мікротрубочки та мікрофіламенти, які відіграють роль цитоскелета, тощо. Пружний і міцний фібрилярний білок колаген є головним компонентом хрящів і сухожиль. Еластин має здатність розтягуватись, тому входить до складу легень, стінок кровоносних судин, міститься у зв’язках. Фібрилярний білок кератин є компонентом волосся, нігтів і пір’я, а з фіброїну складаються шовкові нитки і павутиння. Деякі білкові комплекси (так звані молекулярні мотори) можуть, використовуючи заощаджену клітиною енергію, істотно змінювати свою просторову структуру, виконуючи скорочувальну, або рухову, функцію. Прикладами молекулярних моторів є комплекс актину і міозину, який входить до складу скелетних та інших м’язів, міжмолекулярні комплекси, що забезпечують обертальний рух джгутиків у бактерій та одноклітинних, тощо.
Захисну функцію виконують спеціалізовані білки імуноглобуліни (або антитіла). Вони здатні «розпізнавати» бактерії, віруси, сторонні для організму сполуки (так звані антигени), які потім знешкоджуються клітинами імунної системи (мал. 16.5). Білки інтерферони - неспецифічні фактори противірусного імунітету, які пригнічують розмноження вірусів. На їхній основі створені лікувальні противірусні препарати. Білки крові (наприклад, тромбопластин, тромбін, фібриноген) беруть участь у процесах її зсідання, утворення тромбів, запобігаючи крововтратам при ушкодженні стінок кровоносних судин. Захисну функцію можуть виконувати й деякі ферменти, наприклад лізоцим.
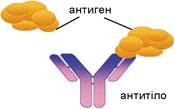
Мал. 16.5. Реакція антиген-антитіло. Завдання: пригадайте, чому певне антитіло може взаємодіяти лише з певним антигеном
Численні білки, специфічно взаємодіючи з певними макромолекулами, регулюють процеси реалізації спадкової інформації та окремі ланки обміну речовин. Деякі складні білки клітинних мембран здатні «розпізнавати» специфічні хімічні сполуки і певним чином на них реагувати. На цій сигнальній функції ґрунтується явище подразливості організмів.
Транспортна функція. Плазма крові містить ліпопротеїди, що забезпечують транспорт ліпідів. Усередині клітини ліпіди також переносяться транспортними білками до інших органел (наприклад, мітохондрій). Білки, вбудовані в клітинну мембрану, забезпечують транспорт речовин у клітину та з клітини назовні (знайдіть їх на мал. 16.3, 3). Білок гемоглобін, який міститься в еритроцитах людини та інших хребетних, плазмі крові різних безхребетних тварин, забезпечує транспорт кисню та СО2. Деякі білки можуть слугувати формою заощадження поживних речовин.
Завдання: пригадайте знання, отримані під час вивчення біології в минулі роки, і наведіть приклади резервної функції білків.
Ключові терміни та поняття
біополімери, стандартні амінокислоти, ферменти (ензими), кофактор, кофермент, апофермент.
Перевірте здобуті знання
1 Чим стандартні амінокислоти відрізняються від тих, які не трапляються у складі білків? 2. Що спільного та відмінного в будові та функціях глобулярних і фібрилярних білків? 3. Чому противірусні ліки створюють на основі інтерферонів, а не імуноглобулінів? 4. Чому без участі ферментів перебіг біохімічних реакцій у клітинах та організмах неможливий? 5. Чим пояснюється специфічність ферментів?
Поміркуйте
У результаті ферментативних реакцій, на відміну від безферментних, не утворюються побічні продукти, тобто спостерігається майже 100 %-й вихід кінцевого продукту. Яке це має значення для нормального функціонування організму?
Коментарі (0)