Явище періодичної зміни властивостей елементів та їхніх сполук на основі уявлень про електронну будову атомів
- 16-11-2023, 13:53
- 263
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 3. ЯВИЩЕ ПЕРІОДИЧНОЇ ЗМІНИ ВЛАСТИВОСТЕЙ ЕЛЕМЕНТІВ ТА ЇХНІХ СПОЛУК НА ОСНОВІ УЯВЛЕНЬ ПРО ЕЛЕКТРОННУ БУДОВУ АТОМІВ
Опанувавши матеріал параграфа, ви зможете:
- знати, чому періодично змінюються властивості елементів та їхніх простих і складних речовин;
- називати металічні та неметалічні елементи за розміщенням у періодичній системі, ураховуючи електронну будову атомів;
- обґрунтовувати періодичну зміну радіусів атомів та йонів, електронегативності, ступенів окиснення, властивостей елементів та їхніх простих речовин на основі електронної будови їхніх атомів;
- висловлювати судження щодо застосування періодичного закону для передбачення властивостей ще не відкритих елементів.
Періодична зміна властивостей елементів. У попередніх параграфах ви ознайомилися з будовою електронних оболонок атомів елементів, їхніми електронними конфігураціями та графічними електронними формулами. За допомогою періодичної системи можна скласти електронні формули кожного з хімічних елементів. Зважаючи на те, що властивості елементів періодично повторюються, узагальнимо від чого залежать їхні періодичні зміни.
Вам уже відомо, що електронна конфігурація атома пояснює періодичні зміни таких характеристик атома, як радіус, електронегативність, валентність і ступінь окиснення, що визначають хімічні властивості елементів та їхніх сполук. Розглянемо це докладніше.
Радіус атома. Через хвильовий характер руху електронів навколо ядра радіуси атомів не мають чітких меж. Крім того, форма орбіталей електронів є різною. Якщо припустити, що атоми мають форму кулі, то радіус атома визначають як віддаль від ядра до зовнішнього енергетичного рівня. Інакше кажучи, поняття «атомний радіус» є умовним. Якщо треба встановити числові значення радіусів атомів елементів, то їх визначають експериментально, ураховуючи довжини хімічних зв'язків між атомами в сполуці. Одиницею вимірювання атомних радіусів є нанометр (нм): 1 нм = 1 · 10-9 м.
У межах одного періоду кількість енергетичних рівнів в атомів елементів не змінюється, однак зростає заряд ядра атома, отже, посилюється притягання ядром атома електронів зовнішнього енергетичного рівня. Унаслідок цього від початку до кінця періоду радіуси атомів незначно зменшуються. Тому в елементів одного малого періоду металічні властивості плавно змінюються на неметалічні. Такі самі зміни відбуваються в парних рядах великих періодів.
Звернімо увагу на зміни, які відбуваються з радіусами йонів, оскільки вони відрізняються від радіусів атомів елементів. Якщо атоми віддають електрони зовнішнього енергетичного рівня, то радіус йона зменшується. Це властиво металічним елементам. Атоми неметалічних елементів приєднують електрони, що є причиною збільшення розмірів йонів. Отже, радіуси катіонів завжди менші від радіусів аніонів та електронейтральних атомів.
Наведіть приклади катіонів та аніонів, утворених елементами 3 періоду. Укажіть величину їхніх зарядів.
З'ясуємо, як змінюються радіуси атомів у групах періодичної системи. Через те, що в атомів елементів кожного наступного періоду формується новий енергетичний рівень, у них періодично збільшуються радіуси атомів. Як наслідок, спостерігається різка зміна властивостей елементів та їхніх сполук. Щодо радіусів йонів однакового заряду, то вони збільшуються із зростанням зарядів ядер.
Електронегативність. З цим поняттям ви ознайомилися в курсі хімії 8 класу. Електронегативність елемента — це властивість атома, що характеризує здатність притягувати до себе спільні електрони під час утворення хімічних зв'язків. Ця здатність змінюється в періодах і групах залежно від розміщення елемента в періодичній системі.
Одиницею електронегативності вважають електронегативність Літію. Її порівнюють з іншими елементами, тому для інших елементів вона є відносною величиною, тобто відносною електронегативністю. Розглянемо, як змінюється електронегативність елементів у періодах і групах періодичної системи (табл. 4).
Таблиця 4
Зміна відносної електронегативності елементів у періодах і групах
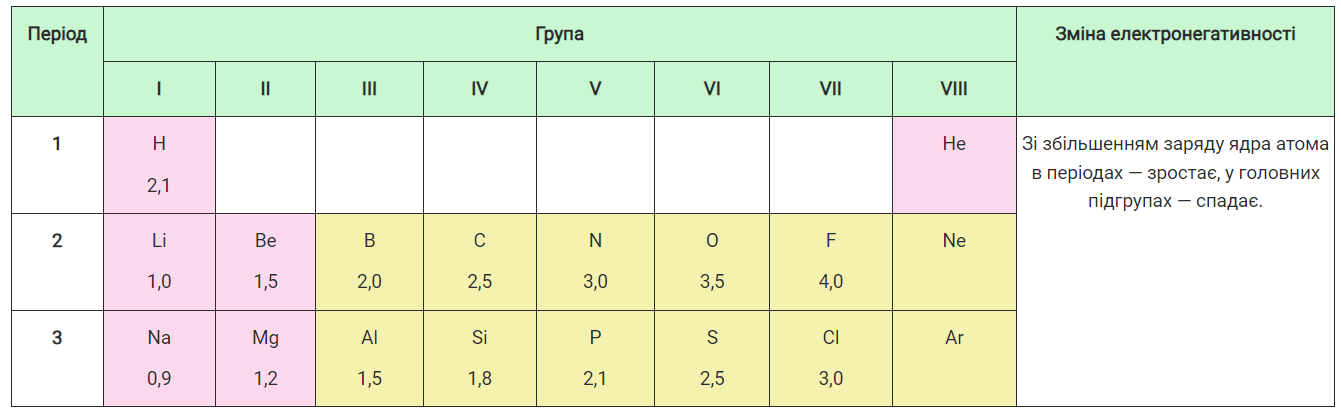
Отже, зі збільшенням заряду ядра атома електронегативність у періодах систематично зростає, а в підгрупах — спадає. Найбільшу електронегативність проявляє Флуор.
За допомогою поняття «відносна електронегативність» пояснюють механізми утворення хімічного зв'язку.
Валентність і ступінь окиснення. Фізичний зміст валентності атомів елементів полягає в їхній здатності утворювати хімічні зв'язки. Валентність — це кількість ковалентних хімічних зв'язків, якими атом сполучений з іншими атомами. З погляду будови атома в утворенні ковалентних зв'язків беруть участь неспарені електрони зовнішнього енергетичного рівня.
Проте вам відомо, що існує безліч речовин немолекулярної будови, тому поняття «валентність» втрачає свою визначеність. Для них використовують поняття «ступінь окиснення».
Ступінь окиснення — це умовний заряд атома, якщо припустити, що сполука складається тільки з йонів. Він може набувати: позитивного значення, якщо атом під час утворення сполуки віддає електрони; негативного — у разі приєднання атомом електронів або нульового, якщо утворюється сполука з ковалентним неполярним зв'язком.
Пригадайте, як позначають ступінь окиснення та як його проставляють.
Під час переходу атома елемента в збуджений стан усі неспарені електрони зовнішнього енергетичного рівня беруть участь в утворенні хімічних зв'язків. Тому максимальна валентність атомів більшості елементів та їхні ступені окиснення відповідають номеру групи, у якій розміщується елемент у періодичній системі. Наприклад, в атома Хлору в третьому збудженому стані два р-електрони й один s-електрон третього рівня переходять на d-підрівень. Це відбувається в атомах елементів побічних підгруп, у яких на зовнішньому енергетичному рівні валентними є s-електрони та d-електрони передостаннього енергетичного рівня.
Мінімальний ступінь окиснення (негативний) визначають за кількістю приєднаних атомом електронів, щоб його зовнішній енергетичний рівень став завершеним. Здебільшого його обчислюють так: 8 мінус номер групи, у якій розміщений елемент.
Визначаючи ступінь окиснення в бінарних і складніших сполуках, необхідно пам'ятати правило: усередині однієї молекули сполуки сума позитивних зарядів дорівнює сумі негативних.
Пригадайте й обчисліть валентність і ступені окиснення елементів у сполуках за наведеними формулами: ZnCl2, Cl2O7, NH3, N2, Cl2.
Знаючи ступені окиснення елементів, складають формули бінарних сполук.
Ступінь окиснення атомів у сполуках, що складаються з трьох елементів. Розглянемо, наприклад, як визначають ступінь окиснення в натрій сульфаті. Формула сполуки Na2SO4. Передусім звертаємо увагу на те, який з елементів найбільш електронегативний з тих, що входять до складу сполуки. Це Оксиген, ступінь окиснення якого дорівнює -2. Чотири атоми Оксигену матимуть сумарний заряд -8.
Металічний елемент Натрій проявляє ступінь окиснення +1, оскільки в його атомі на зовнішньому енергетичному рівні міститься один електрон. Два атоми Натрію віддають два електрони, тому їхній сумарний заряд +2. Будь-яка сполука є електронейтральною, тобто сума позитивних і негативних зарядів має бути однаковою. Отже, ступінь окиснення Сульфуру дорівнює різниці зарядів Оксигену й Натрію та становить +6. Сполука електронейтральна.
Значення періодичного закону в розвитку науки. З відкриттям періодичного закону, який дав уявлення про взаємозв'язки між усіма хімічними елементами, хімічна наука почала швидко розвиватися. У періодичній таблиці залишилися незаповнені Д. І. Менделєєвим клітинки, що створило умови для передбачення нових хімічних елементів — Скандію, Галію, Германію та інших і стало великим стимулом до відкриття цих елементів ще за життя вченого.
Упродовж багатьох років з часу відкриття періодичного закону вчені різних країн світу працювали над відкриттям нових хімічних елементів. Було відкрито лантаноїди й актиноїди. На основі періодичної системи вчені передбачили, що в 7 періоді має бути 32 елементи, а у 8 періоді — 50. У 2011 р. до періодичної системи внесено два елементи: 114 — Унунквадій та 116 — Унунгексій. У 2016 р. періодична система поповнилася ще чотирма елементами, відкритими вченими США, Японії та Росії. Ці елементи: 113 — Унунтрій, 115 — Унунпентій, 117 — Унунсептій та 118 — Унуноктій — верифіковано Міжнародним союзом теоретичної і прикладної хімії (IUPAC) і додано в таблицю Менделєєва, де вони завершили сьомий період таблиці. Їхні назви тимчасові, згодом вони будуть замінені на постійні.
Отже, теорія будови атома пояснила, чому в періодичній системі періодично змінюються властивості елементів, їхніх простих і складних речовин. На її основі вчені відкриватимуть дедалі більше нових хімічних елементів. Знання та застосування явища періодичної зміни властивостей елементів та їхніх сполук на основі уявлень про електронну будову атомів дає змогу керувати виробничими процесами, що відбуваються з речовинами, синтезувати нові хімічні елементи та речовини.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Електронна конфігурація атомів пояснює періодичні зміни таких характеристик атома, як радіус, електронегативність, валентність і ступінь окиснення, що визначають хімічні властивості елементів та їхніх сполук.
• У межах одного періоду кількість енергетичних рівнів в атомів елементів не змінюється, але збільшується заряд ядра атома. Унаслідок цього від початку до кінця періоду радіуси атомів незначно зменшуються. Тому в елементів одного малого періоду й у парних рядах великих періодів металічні властивості елементів плавно змінюються на неметалічні.
• В атомів елементів кожного наступного періоду формується новий енергетичний рівень, що спричиняє різке збільшення радіуса атома й, відповідно, зміну властивостей елементів та їхніх сполук.
• Електронегативність елемента характеризується здатністю атома притягувати електрони під час утворення хімічних зв'язків. Зі зростанням заряду ядра атома електронегативність у періодах зростає, а в підгрупах спадає. Найбільшу електронегативність проявляє Флуор.
• Валентність і ступінь окиснення — поняття неоднозначні. Валентність визначається здатністю атомів елементів утворювати хімічні зв'язки, а ступінь окиснення — це умовний заряд атома, якщо припустити, що сполука складається тільки з йонів. Максимальна валентність атомів більшості елементів та їхні ступені окиснення відповідають номеру групи, у якій міститься елемент у періодичній системі. Мінімальний ступінь окиснення (негативний) обчислюють за формулою 8 мінус номер групи, у якій міститься елемент.
• Визначаючи ступінь окиснення в бінарних і складніших сполуках, необхідно пам'ятати правило: усередині однієї молекули сполуки сума позитивних зарядів дорівнює сумі негативних.
• Відкриття періодичного закону спричинило справжню революцію в хімічній науці. На основі наукових прогнозів було відкрито нові хімічні елементи. Так, у 2016 р. в періодичну систему внесено чотири елементи й вони повністю завершили 7 період.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Поясніть на основі електронних конфігурацій атомів, як змінюється радіус атома: а) у періодах; б) у групах.
- 2. Поясніть, як змінюються властивості елементів та їхніх простих речовин з накопиченням електронів у періодах і збільшенням радіусів атомів у головних підгрупах.
- 3. Поясніть на основі електронної будови атомів, як змінюється електронегативність елементів: а) у періодах; б) у групах.
- 4. Поясніть, чим відрізняються валентність і ступінь окиснення.
- 5. Визначте валентність і ступені окиснення в сполуках, формули яких такі: НСl, FeS, Mg3N2, H2, H2S, Cl2. Поясніть отриманий результат.
- 6. Визначте, користуючись періодичною системою, максимальну валентність і ступені окиснення елементів: а) Фосфору; б) Хрому; в) Мангану.
- 7. Визначте за розміщенням у періодичній системі максимальні й мінімальні ступені окиснення неметалічних елементів: а) Силіцію; б) Нітрогену; в) Хлору.
ЦІКАВО ЗНАТИ
• Голова групи дослідників, які відкрили 113 елемент, японський учений Косуке Моріта повідомив про продовження роботи над відкриттям 119 елемента.
• Понад 10 років велася суперечка за авторство 113 елемента, який було отримано у вересні 2004 р. унаслідок зіштовхування на прискорювачі двох елементів — Zn-30 і Bi-83. Учені із США та Росії оголосили, що створили 113 елемент у процесі синтезу 115 елемента в м. Дубні в лютому 2004 р. і запропонували назвати його Бекерелієм. Однак IUPAC вважав недостатніми докази того, що був створений саме 113 елемент. Упродовж 10 років міжнародні організації вивчали подані обома сторонами матеріали досліджень синтезу 113 елемента (Режим доступу: http://cikavahimiya.blogspot.com/2015/12/113.html).
НАВЧАЛЬНІ ПРОЕКТИ
- 1. Створення 3D-моделей атомів елементів.
- 2. Застосування радіонуклідів у медицині.
- 3. Використання радіоактивних ізотопів як індикаторів у тваринництві, археології.
Коментарі (0)