Кислі солі. Якісні реакції на деякі йони
- 16-11-2023, 14:12
- 344
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 32. КИСЛІ СОЛІ. ЯКІСНІ РЕАКЦІЇ НА ДЕЯКІ ЙОНИ
Опанувавши матеріал параграфа, ви зможете:
- називати кислі солі;
- порівнювати склад і будову середніх і кислих солей;
- характеризувати хімічні властивості кислих солей; поширення солей у природі;
- складати рівняння реакцій, що характеризують хімічні властивості кислих солей;
- досліджувати якісний склад солей.
Склад кислих солей. Кислі солі — це продукти неповного заміщення атомів Гідрогену в молекулі кислоти на катіони металічних елементів. Їх утворюють тільки багатоосновні кислоти. Наприклад, сульфатна й карбонатна кислоти утворюють гідрогенсульфати й гідрогенкарбонати — KHSO4 й NaHCO3, а ортофосфатна кислота може утворювати два види кислих солей: дигідрогенортофосфати — NaH2PO4, КН2РО4, NH4H2PO4 та гідрогенортофосфати — Na2HPO4, СаНРО4, (NH4)2HPO4, Аl2(НРО4)3.
Назви кислих солей. Ознайомимося зі схемою утворення назв кислих солей (рис. 54).

Рис. 54. Схема утворення назв кислих солей
Назвемо деякі кислі солі за їхніми формулами: NaHCO3 — натрій гідроген-карбонат; NaH2PO4 — натрій дигідрогенортофосфат; К2НРО4 — калій гідрогенортофосфат; КН2РО4 — калій дигідрогенортофосфат.
Усі дигідрогенортофосфати добре розчинні у воді, а гідрогенортофосфати — значно гірше.
Хімічні властивості. 1. Кислі солі, маючи у своєму складі атоми Гідрогену, реагують з лугами з утворенням середніх солей. Наприклад:
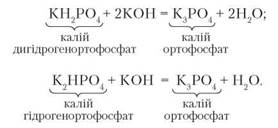
2. Взаємодія із сильними кислотами. Рівняння реакції:
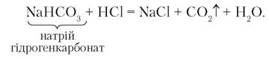
Реакція відбувається, якщо із сильними кислотами реагують кислі солі слабких кислот.
3. Розклад за нагрівання:
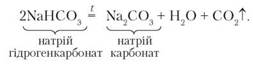
Унаслідок реакції утворюється середня сіль натрій карбонат, вода й виділяється газ.
Взаємоперетворення середніх і кислих солей. Взаємоперетворення карбонатів. Відомо, що внаслідок різних природних процесів (дихання та гниття, горіння сухої трави), а також господарської діяльності людей в атмосферу потрапляє велика кількість карбон(IV) оксиду. Тому карбонати можуть перетворюватися на гідрогенкарбонати під час їхньої взаємодії з карбон(ІV) оксидом за наявності води. Рівняння реакцій:
СаСО3 + СО2 + Н2О = Са(НСО3)2;
MgCO3 + СО2 + Н2О = Mg(HCO3)2.
Перетворення кальцій карбонату на кальцій гідрогенкарбонат можна спостерігати й у лабораторних умовах. Проведемо дослід.
Дослід 1. Наллємо в пробірку вапняну воду об'ємом 2-3 мл. Опустимо в неї газовідвідну трубку й пропустимо карбон(ІV) оксид, який виділяється під час реакції кальцій карбонату з хлоридною кислотою. Через деякий час у пробірці утворюється білий осад — кальцій карбонат. Відбулася реакція:
Са(ОН)2 + СО2 = СаСО3↓ + H2O.
Дослід 2. Продовжимо пропускати карбон(ІV) оксид крізь отриманий у досліді 1 осад. За декілька хвилин осад розчиняється. Утворився розчинний у воді кальцій гідрогенкарбонат. Рівняння реакції:
СаСО3+ СО2 + Н2О = Са(НСО3)2.
Взаємоперетворення ортофосфатів. Ортофосфати, як і карбонати, у реакціях з кислотами перетворюються на кислі солі. Так, залежно від співвідношення солі та кислоти, утворюються гідроген- або дигідрогенортофосфати:
Mg3(PO4)2+ Н3РО4 = 3MgНРО4;
Mg3(PO4)2+ 4Н3РО4 = 3Mg(Н2РО4)2;
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4.
Назвіть самостійно кислі солі, що утворилися під час реакцій.
Якісні реакції на деякі йони. Ортофосфат-аніон можна виявити за допомогою якісної реакції. Якщо до розчину солі ортофосфатної кислоти долити розчин аргентум(І) нітрату AgNO3, то спостерігатиметься випадання жовтого осаду Ag3PO4. Рівняння реакції:
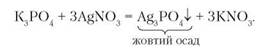
Отже, реактивом на ортофосфат-аніон РО3-4 є катіон Ag+. Щоб переконатися в цьому, проведемо лабораторний дослід.
Лабораторний дослід 7. Виявлення в розчині ортофосфат-аніонів
Завдання. Дослідіть, як виявити ортофосфат-аніони в розчинах.
Обладнання та реактиви: дві пробірки, розчини натрій та калій ортофосфатів, аргентум(І) нітрату.
Увага! Повторіть правила безпеки під час роботи з реактивами й обладнанням і суворо дотримуйтеся їх.
Дослід. Налийте по черзі у дві пробірки розчини натрій та калій ортофосфатів об'ємом по 1,5-2 мл і додайте такий самий об'єм розчину аргентум(І) нітрату. Спостерігайте випадання осаду. Опишіть спостереження. Складіть рівняння реакцій, зробіть висновок.
Оформте результати досліджень у зошиті як таблицю.
Серед силікатів розчинними є натрій та калій силікати. Силікат-аніон виявляють у розчинах за допомогою сильних кислот. Якщо до розчину натрій силікату долити хлоридну кислоту, то випаде осад білого кольору, який має здатність розчинятися в лугах. Рівняння реакції:
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl.
Реактивом на силікат-аніон є катіон Гідрогену.
Переконаємося в цьому, провівши лабораторний дослід.
Лабораторний дослід 8. Виявлення в розчині силікат-аніонів
Завдання. Дослідіть, як виявити силікат-аніони в розчинах.
Обладнання та реактиви: дві пробірки, розчини натрій та калій силікатів, сульфатної кислоти, хлоридна кислота.
Увага! Повторіть правила безпеки під час роботи з реактивами й обладнанням і суворо дотримуйтеся їх.
Дослід 1. Налийте по черзі в першу пробірку розчин натрій силікату, у другу — калій силікату об'ємом по 1,5-2 мл і додайте такий самий об'єм: у першу пробірку — розчину сульфатної кислоти, у другу — хлоридної кислоти. Спостерігайте випадання осаду. Опишіть спостереження. Складіть рівняння реакцій, зробіть висновок.
Дослід 2. До кожної пробірки з осадом долийте 1-2 мл розчину натрій гідроксиду. Спостерігайте розчинення осадів. Складіть рівняння реакцій, зробіть висновок.
Оформте результати досліджень у зошиті як таблицю.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Кислі солі — продукти неповного заміщення атомів Гідрогену в молекулі кислоти на катіони металічних елементів.
• Назви кислих солей утворюють від назви катіона металічного елемента з додаванням гідроген (дигідроген), сполученого з назвою кислотного залишку.
• Кислі солі вступають у хімічну взаємодію з лугами та сильними кислотами, розкладаються за нагрівання; середні та кислі солі взаємоперетворюються.
• Ортофосфати можна виявити серед інших речовин у розчині за допомогою якісних реакцій. Реактивом на ортофосфат-аніон РО3-4 є катіон Ag+.
• Реактивом на силікат-аніон є катіон Гідрогену.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Назвіть солі за їхніми формулами: Mg3(PO4)2, NaHSO4, FeCl3, K2HPO4, NH4NO3, Ca(H2PO4)2, (NH4)2SO4, NaHCO3, MgHPO4, K2SiO3, Na2CO3.
- 2. Допишіть праві частини рівнянь реакцій, доберіть коефіцієнти:
a) NaH2PO4 + NaOH = ... ;
б) K2HPO4 + KOH = ... ;
в) Mg3(PO4)2 + H2SO4 = ... ;
г) К3РО4 + AgNO3 = ... .
- 3. Складіть рівняння реакцій за наведеною схемою:
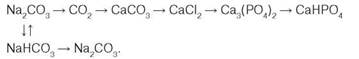
- 4. Крізь розчин кальцій гідроксиду масою 22,2 г пропустили карбон(IV) оксид до повної взаємодії. Утворився кальцій карбонат масою 25 г. Обчисліть відносний вихід продукту реакції.
- 5. Натрій ортофосфат масою 40 г піддали дії аргентум(І) нітрату масою 102 г. Обчисліть масу аргентум(І) ортофосфату, що випав в осад.
- 6. На калій силікат масою 51,6 г подіяли сульфатною кислотою масою 42 г. Обчисліть масу й кількість речовини утвореної силікатної кислоти.
- 7. На амоній хлорид масою 12 г подіяли натрій гідроксидом та отримали натрій хлорид масою 11,7 г. Обчисліть кількість речовини, якій відповідає така маса натрій хлориду, та об'єм амоніаку (н. у.), що утвориться під час реакції.
Коментарі (0)