Природа хімічного зв'язку. Йонний зв'язок
- 27-11-2023, 13:30
- 295
11 клас , Хімія 11 клас Григорович (рівень стандарту)
§ 5. Природа хімічного зв'язку. Йонний зв'язок
Пригадайте:
• розрізняють чотири типи хімічного зв'язку: йонний, ковалентний, водневий та металічний;
• валентними називають електрони зовнішніх енергетичних рівнів;
• лужні елементи — це елементи IА групи, галогени — елементи VIIA групи;
• катіони — позитивно заряджені йони, а аніони — негативно заряджені.
Електронна природа хімічного зв'язку
1897 року після відкриття електрона англійським фізиком Дж. Томсоном було висловлене припущення, що хімічні зв'язки мають електронну природу й утворюються завдяки зміщенню або перенесенню електронів від одного атома до іншого.
Електронну природу можна проілюструвати енергетичною діаграмою взаємодії двох атомів Гідрогену, що залежить від відстані між ними (мал. 5.1). На великій відстані взаємодією атомів один з одним можна знехтувати, і під час їх зближення до певного моменту їхня сумарна енергія не змінюватиметься. У міру їх зближення ядро одного атома притягує електрон іншого, і навпаки. Між атомами виникає взаємодія, і відстань між ними зменшується доти, поки взаємне притягання не врівноважиться відштовхуванням двох позитивних ядер.
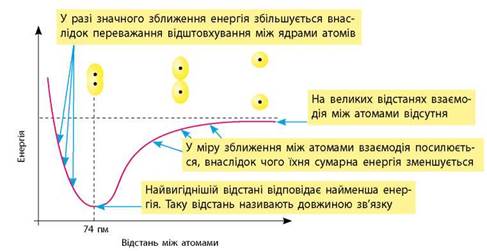
Мал. 5.1. Енергетична діаграма сумарної енергії двох атомів Гідрогену залежно від відстані між ними, 1 пм = 10-12 м
Енергія двох окремих атомів більша, ніж енергія молекули, утвореної цими двома атомами (мал. 5.1, с. 25). А прагнення до зменшення енергії — це рушійна сила будь-яких взаємодій. Зменшення енергії молекули в порівнянні з енергією окремих атомів — причина утворення хімічного зв'язку:
• Хімічний зв'язок — це взаємодія атомів, що зумовлює стійкість багатоатомних частинок (молекул, йонів, кристалів).
Електронну теорію хімічного зв'язку запропонував 1916 року американський хімік Джилберт Льюїс.
Умови виникнення хімічного зв'язку
Умови виникнення хімічного зв'язку ґрунтуються на будові електронних оболонок атомів. Дж. Льюїс визначив, що електронні оболонки атомів інертних елементів відзначаються особливою стійкістю, чим і пояснюється їхня хімічна інертність. Атоми всіх інших елементів під час утворення хімічного зв'язку прагнуть змінити електронну оболонку, щоб набути електронної конфігурації атомів найближчого інертного елемента, віддаючи або приєднуючи електрони. Тільки в такому випадку утворюються стійкі молекули. Оскільки атоми всіх інертних елементів (крім Гелію) містять на зовнішньому рівні по вісім електронів, то прагнення до конфігурації інертного елемента називають правилом октету Льюїса (від латин. окто — вісім).
Йонний зв'язок
• Хімічний зв'язок, що реалізується за рахунок притягання протилежно заряджених йонів, називають йонним.
Йонний зв'язок існує в речовинах, утворених металічними та неметалічними елементами. Така речовина може утворитися, наприклад, під час взаємодії металу з неметалом.
Йонний зв'язок:
• виникає між протилежно зарядженими йонами;
• існує між одно- та багатоатомними йонами в солях, гідроксидах та деяких оксидах металічних елементів
Йонний зв'язок зумовлений наявністю в речовині вільних йонів (катіонів та аніонів). Катіони можуть утворитися з атомів металічних елементів у разі втрачання електронів, а аніони — з атомів неметалічних, що приймають електрони. Аніони також можуть утворитися з молекул кислот під час електролітичної дисоціації. Між різнойменно зарядженими йонами виникає електростатичне притягання, причому сила притягання залежить від зарядів йонів та їхніх радіусів.
Класичним прикладом утворення речовини з йонним зв'язком є хімічна взаємодія натрію та хлору, під час якої утворюються катіони Натрію Na+ та хлорид-іони Cl-:
2Na + Cl2 = 2NaCl
Na0 - e- → Na+
Cl0 + e- → Cl-
Атом Натрію віддає електрон атому Хлору. При цьому обидва атоми перетворюються на йони з електронною конфігурацією атомів інертного елемента.
У натрій хлориді, що утворився, містяться катіони Натрію та хлорид-аніони. У кристалі вони між собою не зв'язані жорстко, а утримуються разом завдяки притяганню між протилежно зарядженими йонами (мал. 5.2).

Мал. 5.2. У кристалі натрій хлориду йони утримуються йонним зв'язком
Розглянемо інший приклад: взаємодію магнію з розбавленою сульфатною кислотою. Під час реакції атоми Магнію віддають два електрони і перетворюються на йони Магнію Mg2+. Окисником у цій реакції є йони Гідрогену, які приймають електрони і перетворюються на атоми Гідрогену, а сульфат-іони змін не зазнають:
Mg + H2SO4 = MgSO4 + H2↑
Mg0 - 2e- → Mg2+
2H+ + 2e- → 2H0 → H2↑
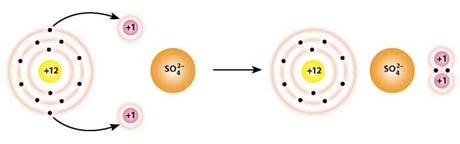
Під час реакції магнію із сульфатною кислотою частинки обмінюються електронами
Якщо випарити воду після проведення такого досліду, то залишиться кристалічна речовина — магній сульфат, що складається з йонів Магнію та сульфат-іонів, сполучених йонним зв'язком (мал. 5.3).

Мал. 5.3. Магній сульфат — речовина з йонним зв'язком
Отже, йонний зв'язок характерний для солей, а також для інших сполук, у яких існують йони: основних оксидів та лугів.
Ключова ідея
Речовини з йонним зв'язком складаються з протилежно заряджених одно- або багатоатомних йонів, що утримуються один з одним електростатичним притяганням.
Контрольні запитання
60. У чому виявляється електронна природа хімічного зв'язку?
61. Схарактеризуйте зміну сумарної енергії двох атомів Гідрогену залежно від відстані між ними. Поясніть причину цих змін.
62. Дайте визначення: а) хімічному зв'язку; б) йонному зв'язку. Завдяки яким взаємодіям вони утворюються?
63. Схарактеризуйте умови виникнення хімічного зв'язку.
64. Для яких сполук характерний йонний зв'язок?
Завдання для засвоєння матеріалу
65. Чому одні атоми взаємодіють один з одним, а інші — ні?
66. За якими ознаками можна визначити атоми, що здатні утворити хімічний зв'язок? Поясніть, чому «не вигідно» утворення молекули He2.
67. Скільки електронів не вистачає до октету атомам Карбону, Брому, Сульфуру, Хлору, Фосфору, Нітрогену?
68. До електронної конфігурації атомів яких інертних елементів прагнуть атоми Натрію, Сульфуру, Калію, Алюмінію, Брому? Атоми цих елементів прагнуть віддавати чи приєднувати електрони в разі утворення хімічних зв'язків?
69. Визначте, скільки електронів можуть віддати атоми кальцію, Берилію, Літію, Алюмінію, Нітрогену, Брому.
70. Зобразіть схему утворення йонів із нейтральних атомів на прикладі: а) калій флуориду; б) магній оксиду; в) алюміній броміду.
71. Зобразіть схему утворення йонів під час взаємодії металів із кислотами для утворення солей: а) алюміній хлориду; б) цинк сульфату; в) ферум(ІІ) сульфіту; г) натрій карбонату.
72. Визначте хімічну формулу частинки (атома чи йона) за відомим протонним числом та будовою зовнішнього енергетичного рівня: а) р = 1, 1s0; б) р = 4, 1s2; в) р = 8, 2s2 2p6; г) р = 9, 2s22p6; д) р = 12, 2s22p6; е) р = 26, 3s23p63d6.
73. Утворення стабільної частинки — це енергетично вигідний процес, який відбувається з виділенням теплоти. Визначте, який процес відбувається з виділенням теплоти, а який — із поглинанням: а) He0 → He+; б) Cs0 → Cs+; в)F0 → F+; г) Cl- → Cl0; д) Br0 → Br-; е) K0 → K-; є) Ca2+ → Ca0.
Коментарі (0)