Поняття про жорсткість води та способи її усунення
- 16-11-2023, 14:15
- 453
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 36. ПОНЯТТЯ ПРО ЖОРСТКІСТЬ ВОДИ ТА СПОСОБИ ЇЇ УСУНЕННЯ
Опанувавши матеріал параграфа, ви зможете:
- називати види жорсткості води та способи її усунення;
- пояснювати чинники, що впливають на жорсткість води; процеси, що відбуваються під час усунення жорсткості води; вплив жорсткої води на здоров'я людини, побутові прилади й комунікації;
- складати рівняння реакцій, що усувають карбонатну та некарбонатну жорсткість води.
Жорсткість води. Вивчаючи середні та кислі солі, ви ознайомилися із солями Кальцію та Магнію. Дослідженнями вод деяких морів, водоймищ і джерел виявлено, що в ній може бути надмірна кількість розчинних гідрогенкарбонатів, зокрема Кальцію та Магнію. Саме катіони Са2+ і Mg2+ створюють жорсткість води, що сягає до 10 ммоль у літрі води. У дощовій воді вміст цих сполук приблизно в 5 разів менший. Крім гідрогенкарбонатів, у жорсткій воді наявні й розчинні хлориди й сульфати Кальцію та Магнію.
Залежно від того, які солі наявні у воді, розрізняють два види її жорсткості (рис. 59).
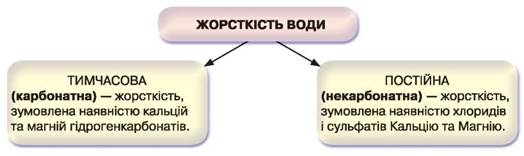
Рис. 59. Види жорсткості води
Способи усунення жорсткості води. Найпростіший спосіб усунення тимчасової (карбонатної) жорсткості води — її кип'ятіння. Ви неодноразово бачили, як на внутрішній поверхні чайників утворюється вапняний накип. Це і є ті нерозчинні у воді карбонати, що випадають в осад за кип'ятіння.
Пригадайте взаємоперетворення карбонатів (§ 32) і складіть самостійно рівняння реакції перетворення кальцій гідрогенкарбонату на кальцій карбонат.
Подібно до того як перетворюється кальцій гідрогенкарбонат, під час кип'ятіння води відбувається перетворення магній гідрогенкарбонату на магній карбонат. Рівняння реакції:
![]()
Тимчасову (карбонатну) жорсткість можна усунути, якщо подіяти вапняним молоком Са(ОН)2. Відбувається реакція:
Ca(HCO3)2 + Са(ОН)2 = 2СаСО3↓+ 2H2O.
Карбонати випадають в осад і під дією кальцинованої соди:
Са(НСО3)2 + Na2CO3 = СаСО3↓ + 2NaHCO3.
Вам відомо, що для прання використовують мило — натрієву сіль стеаринової кислоти. При додаванні мила до води відбувається реакція обміну катіонів Кальцію, що є у воді, на катіони Натрію, що містяться в милі. Унаслідок цього в осад випадає нерозчинний кальцій стеариноат, що призводить до надмірного використання мила під час прання. Рівняння реакції:
Са(НСО3)2 + 2C17H35COONa = (С17Н35СОО)2Са↓ + Na2CO3 + CO2↑ + H2O.
Уважно проаналізуємо всі рівняння реакцій та переконаємося, що в кожному разі гідрогенкарбонати перетворюються на карбонати, які виводяться з розчину, утворюючи нерозчинні карбонати.
Постійну (некарбонатну) жорсткість усувають дією кальцинованої соди. Рівняння реакцій:
CaCl2 + Na2CO3 = СаСО3↓ + 2NaCl;
MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl.
Складіть самостійно рівняння реакцій усунення некарбонатної жорсткості води за наявності в ній кальцій та магній сульфатів.
Додаючи до води одночасно кальциновану соду й вапно, усувають і тимчасову (карбонатну), і постійну (некарбонатну) жорсткість.
Воду зм'якшують не тільки в побутових умовах, а й на великих підприємствах. Один із способів — використання йонообмінних смол, які містять катіони Натрію чи Калію, здатні обмінюватися на катіони Кальцію та Магнію.
Отже, суть процесу зм'якшення води полягає у виведенні з розчину катіонів Кальцію та Магнію, які спричиняють її жорсткість.
Вплив жорсткої води на здоров'я людини. Доведено, що висока концентрація йонів Кальцію та Магнію у воді впливає насамперед на шкіру та волосся. Мило не завжди повністю очищає воду, тому на шкірі залишаються рештки карбонатів. Вони забивають пори, погіршуючи дихання шкіри. Як наслідок, виникають подразнення, висипи, прищі, лупа.
Від жорсткої води псується волосся: воно стає ламким, випадає, з'являється лупа. Тому після миття волосся важливо сполоскувати його кип'яченою водою.
Потрапляючи в надмірній кількості в організм людини, сполуки Кальцію та Магнію призводять до появи каміння в нирках і сечівниках, порушують роботу серцево-судинної системи, жовчних проток та опорно-рухового апарату, на стінках кишечнику осідають шлаки тощо.
У домашніх умовах найефективнішим способом є використання фільтрів йонного обміну, які виробляє промисловість для побутового використання.
Використання жорсткої води спричиняє економічні затрати. На нагрівальних приладах осідає накип, що знижує електропровідність, а отже, зумовлює додаткове витрачання електроенергії. Унаслідок утворення накипу в парові котли та пральні машини можуть зламатися, з часом пристрої виходять з ладу.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Жорсткість води зумовлена наявністю в ній катіонів Кальцію та Магнію.
• Розрізняють тимчасову (карбонатну) і постійну (некарбонатну) жорсткість води.
• Тимчасова жорсткість зумовлена наявністю у воді розчинних кальцій та магній гідрогенкарбонатів: Са(НСО3)2, Mg(HCO3)2. Її усувають кип'ятінням або хімічним способом за допомогою вапняного молока чи кальцинованої соди.
• Постійна жорсткість зумовлена наявністю у воді інших солей Кальцію та Магнію, зокрема хлоридів і сульфатів. Її усувають дією кальцинованої соди:
СаСl2 + Nа2CО3 = СаСО3↓ + 2NaCl;
MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl.
• Жорстка вода негативно впливає на здоров'я людини, викликаючи захворювання шкіри й волосся, нирок, серцево-судинної системи, жовчних проток, опорно-рухового апарату.
• Використання жорсткої води призводить до економічних затрат.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Поясніть причину жорсткості води.
- 2. Назвіть відомі вам види жорсткості води та способи її усунення.
- 3. Для охолодження багатьох реакторів і двигунів використовують воду. Обґрунтуйте, чи можна для цього використовувати жорстку воду. Підтвердьте відповідь рівняннями реакцій.
- 4. Відомо, що вапняне молоко для зм'якшення води можна приготувати кількома способами. Запропонуйте варіанти його отримання й обґрунтуйте, який з них економічно найвигідніший.
- 5. Кальцій карбонат масою 20 кг розклали за нагрівання. Унаслідок реакції його маса зменшилася на 2,2 кг. Обчисліть масу кальцій карбонату, яка розклалася, і масу кальцій оксиду, що утворилася.
- 6. Кальцій гідрогенкарбонат кількістю речовини 0,2 моль піддали інтенсивному нагріванню. Обчисліть масу утвореного кальцій карбонату й об'єм карбон(IV) оксиду (н. у.), що утворилися.
- 7. Некарбонатну жорсткість води, у якій містився кальцій сульфат масою 1,36 г, усунули кальцинованою содою масою 2 г. Обчисліть маси солей, що утворилися внаслідок реакції.
Коментарі (0)