Сульфатна кислота
- 29-11-2023, 23:26
- 353
11 клас , Хімія 11 клас Григорович (рівень стандарту)
§ 22. Сульфатна кислота
Пригадайте:
• розбавленими прийнято вважати розчини, у яких маси розчиненої речовини й розчинника відрізняються більш ніж у 10 разів;
• ступінь дисоціації кислот залежить від їхньої концентрації: чим більш концентрованою є кислота, тим менший ступінь дисоціації.
Фізичні властивості сульфатної кислоти
• Чиста (безводна) сульфатна кислота — безбарвна сиропоподібна гігроскопічна рідина без запаху;
• необмежено змішується з водою;
• tпл. = 10,5 °С, tкип. = 83 °С (без розкладання);
• густина 1,84 г/см3 — майже у два рази важча за воду.

Чиста сульфатна кислота термічно нестійка, за нагрівання вона частково розкладається, виділяючи сульсфур(VI) оксид, тому в лабораторіях зазвичай використовують її 96%-й розчин.
Розчинення сульфатної кислоти у воді супроводжується виділенням великої кількості теплоти, що свідчить про хімічну взаємодію. Сульфатна кислота — важка рідина і в разі потрапляння у воду опускається на дно. Якщо в концентровану кислоту потрапить більш легка вода, то верхній шар рідини дуже розігрівається, розчин закипає, й утворюються бризки. У деяких випадках посудина може тріснути. Готуючи розчин, необхідно обережно вливати сульфатну кислоту у воду, постійно перемішуючи. Не можна лити воду в кислоту (мал. 22.1).
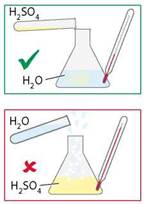
Мал. 22.1. Правило змішування сульфатної кислоти з водою
Хімічні властивості сульфатної кислоти
1. Електролітична дисоціація. Сульфатна кислота — сильний електроліт: у розбавлених водних розчинах молекули сульфатної кислоти повністю дисоціюють за першою стадією з утворенням гідрогенсульфат-іонів:
![]()
За другою стадією сульфатна кислота — електроліт середньої сили. У її розчині з масовою часткою 1 % за другою стадією дисоціює лише 20 % молекул з утворенням сульфат-іонів:
![]()
Оскільки сульфатна кислота двохосновна, то вона утворює два види солей: сульфати та гідрогенсульфати.
2. Реакції обміну. Сульфатна кислота виявляє всі загальні властивості кислот. Вона змінює забарвлення індикаторів та реагує:
• з основними й амфотерними оксидами: ZnO + H2SO4 = ZnSO4 + H2O;
• з основами: 3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O;
• із солями слабкіших кислот: H2SO4 + ZnS = ZnSO4 + H2S↑.
Концентрована сульфатна кислота витісняє із твердих солей леткі кислоти — нітратну й хлоридну:
Н2SO4(конц.) + 2NaCl(тв.) = Na2SO4 + 2HCl↑
Із лугами та гідроксидами, залежно від співвідношення кількості реагентів, можуть утворюватися різні солі:
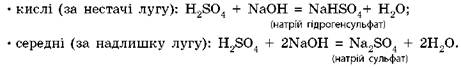
3. Взаємодія з металами. Продукти реакції сульфатної кислоти з металами дуже залежать від концентрації кислоти.
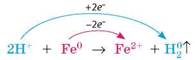
• Розбавлена сульфатна кислота взаємодіє з металами, як і будь-яка сильна кислота. Але вона взаємодіє лише з тими, що розташовані в ряду активності лівіше від водню, з утворенням солі та водню:
H2SO4 + Fe = FeSO4 + H2↑
У цих реакціях сульфатна кислота виявляє слабкі окисні властивості за рахунок йонів H+:
Із неактивними металами (мідь, срібло, ртуть тощо) розбавлена кислота не взаємодіє.
• Концентрована сульфатна кислота за окисними властивостями значно відрізняється від розбавлених водних розчинів. У концентрованих розчинах дисоціація відбувається незначною мірою, тому такі розчини майже не містять йонів Н+, а містять переважно недисоційовані молекули H2SO4. У концентрованих розчинах сульфатна кислота є сильним окисником завдяки S+6 і реагує як з активними металами, так і з малоактивними.
В усіх цих реакціях утворюються відповідні солі (сульфати), але замість водню виділяються продукти відновлення сульфатної кислоти: сульфур(IV) оксид, сірка або гідроген сульфід.
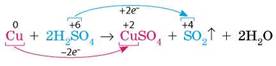
Взаємодія малоактивних металів із концентрованою сульфатною кислотою за нагрівання відбувається з бурхливим виділенням газу, який легко визначити за запахом — сульфур(IV) оксид. Наприклад, із міддю:
Cu + 2Н2SО4(конц.) = CuSO4 + SO2↑ + 2H2O
У цій реакції сульфатна кислота є окисником, а мідь — відновником:
Із металами, розташованими в ряду активності лівіше від водню, залежно від умов (активність металу, концентрація кислоти, температура) утворюються сульфур(IV) оксид, сірка або гідроген сульфід. Наприклад:
4Mg + 5H2SO4 = 4MgSO4 + H2S↑ + 4H2O
3Zn + 4H2SO4 = 3ZnSO4 + S↓ + 4H2O
Концентрована сульфатна кислота пасивує за звичайної температури залізо й алюміній, тобто ці метали з нею не реагують. Завдяки цьому концентровану сульфатну кислоту можна зберігати і перевозити у сталевих цистернах. Але за умови нагрівання реакція може відбутися.
4. Водовідіймаючі властивості. У 9 та 10 класах ви вивчали властивості вуглеводнів та їх відношення до концентрованої сульфатної кислоти. Така кислота виявляє не лише гігроскопічність (поглинання водяної пари з повітря), а й може віднімати воду і від деяких органічних речовин, обвуглюючи їх.
Цукор під час контакту з концентрованою сульфатною кислотою поступово нагрівається й чорніє. Також у концентрованій сульфатній кислоті обвуглюються папір, бавовна та деревина: занурена в неї скіпка миттєво чорніє, перетворюючись на вугілля (мал. 22.2).

Мал. 22.2. Обвуглювання деревини концентрованою сульфатною кислотою
Цю властивість концентрованої сульфатної кислоти використовують у лабораторіях для осушування газів: кислота поглинає воду під час пропускання крізь неї щойно добутих газів. Також ця властивість виявляється у вивчених вами в 10 класі реакціях дегідратації спиртів, дегідрогенгалогенування та естерифікації.
Поводитися із сульфатною кислотою слід дуже обережно, оскільки вона спричиняє сильні опіки, а в тяжких випадках може статися обвуглювання шкіри. У разі потрапляння кислоти на шкіру її треба обережно ввібрати сухою ганчіркою, залишки змити струменем води, а потім промити уражене місце розбавленим розчином питної соди.
Застосування сульфатної кислоти
Сульфатна кислота — найважливіший продукт світової хімічної промисловості. Її виробництво перевищує 100 млн тонн на рік.
• Приблизно три чверті виробленої кислоти йде на виготовлення добрив.
• Також сульфатну кислоту використовують для очищення нафтопродуктів, виготовлення пластмас і хімічних волокон, барвників, ліків, мийних засобів, вибухових речовин, видалення іржі з металевих поверхонь.
• Розчин сульфатної кислоти (33 % за масою) використовують як електроліт у свинцевих акумуляторах.
Ключова ідея
Сульфатна кислота — небезпечна у використанні, але дуже важлива речовина для промисловості та лабораторної практики.
Контрольні запитання
307. Схарактеризуйте фізичні властивості сульфатної кислоти.
308. Якого правила слід дотримуватися під час розбавлення сульфатної кислоти водою? Поясніть свою відповідь.
309. Чому чиста сульфатна кислота не проводить електричний струм, а її водні розчини проводять?
310. Який елемент є окисником у реакціях сульфатної кислоти: а) розбавленої; б) концентрованої?
311. Як буде змінюватися з часом маса відкритої посудини: а) із дуже розбавленим розчином сульфатної кислоти; б) із концентрованою сульфатною кислотою?
312. Схарактеризуйте застосування сульфатної кислоти.
Завдання для засвоєння матеріалу
313. Запишіть рівняння реакцій розбавленої сульфатної кислоти з основою, основним оксидом, сіллю.
314. З якими речовинами з наведеного переліку взаємодіє сульфатна кислота:
а) розбавлена; б) концентрована? запишіть рівняння реакцій.
Fe, Fe(OH)3, SO2, C, CaO, Cu, Na2CO3.
315. З якими наведеними речовинами — мідь, купрум(ІІ) оксид, купрум(ІІ) гідроксид — концентрована сульфатна кислота реагує: а) як окисник; б) як сильна кислота? Запишіть рівняння всіх реакцій.
316. З якими наведеними металами — мідь, магній, срібло, залізо, цинк, ртуть — реагує сульфатна кислота: а) розбавлена; б) концентрована?
317. Запишіть рівняння реакції між твердим магній хлоридом і концентрованою сульфатною кислотою.
318. Складіть рівняння реакцій, що відповідають скороченим йонно-молекулярним рівнянням:
![]()
319. Доберіть коефіцієнти методом електронного балансу:
а) Hg + H2SO4 → HgSO4+ SO2↑ + H2O;
б) Zn + H2SO4 → ZnSO4 + S↓ + H2O;
в) S + H2SO4 → SO2↑ + H2O;
г) KI + H2SO4 → І2 + H2S↑ + K2SO4 + H2O.
320. Складіть рівняння реакцій для здійснення перетворень:
![]()
Комплексні завдання
321. Обчисліть об'єм газу (н. у.), що виділиться під час розчинення міді масою 1,28 г у концентрованій сульфатній кислоті.
322. У розчин масою 500 г із масовою часткою сульфатної кислоти 4,8 % насипали порошок заліза масою 22,4 г. Обчисліть об'єм газу (н. у), що виділився.
323. Обчисліть масу сульфур(VI) оксиду, яку можна добути окисненням сульфур(IV) оксиду об'ємом 560 л (н. у.), якщо відносний вихід продукту реакції становить 85 %.
Завдання з розвитку критичного мислення
324. Які гази можна осушувати концентрованою сульфатною кислотою, а які — ні? Обґрунтуйте свою відповідь та наведіть приклади.
325. Як ви вважаєте, чому сульфатну кислоту іноді називають «хлібом» хімічної промисловості?
Коментарі (0)