Алюміній та залізо: фізичні й хімічні властивості
- 14-11-2023, 22:49
- 390
11 клас , Хімія 11 клас Лашевська (рівень стандарту)
§ 24. Алюміній та залізо: фізичні й хімічні властивості
Після опрацювання цього параграфа ви зможете:
- порівнювати фізичні й хімічні властивості алюмінію та заліза;
- складати рівняння реакцій, що підтверджують їхні відновні властивості.
Фізичні властивості алюмінію та заліза - властивості типових металів. Алюміній - блискуча сріблясто-біла речовина. На повітрі він швидко окиснюється та вкривається тонкою білою матовою плівкою оксиду (складіть хімічну формулу цієї сполуки). З підвищенням ступеня чистоти алюмінію зростає його температура плавлення. Метал високої чистоти плавиться за 660,24 °С. Розплавлений алюміній опиняється в своєрідному чохлі з оксидної плівки, що свідчить про її механічну міцність. Алюміній, подібно до срібла, має високу здатність відбивати світлові та теплові промені, тому його застосовують для виготовлення поверхонь нагрівальних і освітлювальних рефлекторів і дзеркал, елементів декору. Найхарактернішими фізичними властивостями алюмінію є його мала густина (2,7 кг/м3), а також порівняно високі тепло- і електропровідність (поясніть, які властивості алюмінію зумовили його використання для виготовлення електричних дротів, а які - для виготовлення радіаторів парового опалення). У твердому стані алюміній легко піддається куванню, прокатці, волочінню, різанню. З нього можна витягати найтонший дріт і катати фольгу (рис. 24.1). Пластичність алюмінію зростає з підвищенням його ступеня чистоти.

Рис. 24.1. Алюмінієва фольга (1) та профіль (2)
Фізичні властивості заліза також значною мірою залежать від його чистоти. Наприклад, зменшення частки домішок до 0,0000001-0,000000001 % істотно підвищує пластичність цього металу. Чисте залізо в компактному вигляді - сріблясто-біла блискуча речовина. Температура його плавлення - 1539 °С, густина - 7,874 г/см . Залізо досить м’яке, його легко кувати. Цей метал притягується магнітом та легко намагнічується (рис. 24.2).

Рис. 24.2. 1. Самородне залізо. 2. Чисте залізо. 3. Магнітом тягне... 4. Пам’ятна монета НБУ, присвячена ковальству - обробленню заліза методом гарячого кування. Уже в Х—ХII ст. ковальська майстерність досягла такого високого рівня, що навіть деякі способи оброблення заліза та технології виготовлення знарядь праці, предметів побутового призначення без суттєвих змін дійшли до нашого часу
Хімічні властивості алюмінію та заліза багато в чому подібні. Розгляньмо їх докладніше. Обидва метали реагують з неметалами, водою, кислотами та солями в розчинах. Алюміній хімічно дуже активний. Однак досить тонка та дуже міцна оксидна плівка на його поверхні зумовлює його корозійну стійкість.
• Використайте метод електронного балансу й перетворіть схеми реакцій, наведені далі, на хімічні рівняння.
За нагрівання на повітрі чи в кисні алюміній згоряє з утворенням алюміній оксиду (рис. 24.3):
![]()

Рис. 24.3. Видовище горіння алюмінієвої пудри, розпорошеної в полум’ї пальника, захоплює
• Про що свідчить сліпучо-біле полум’я? Класифікуйте цю реакцію за тепловим ефектом, кількістю реагентів і продуктів, схарактеризуйте її з погляду окиснення-відновлення
Залізо згоряє в кисні. Для проведення цієї реакції потрібне попереднє нагрівання. Розігріємо в полум’ї пальника пучок дуже тонкого залізного дроту - так звану залізну вовну. Розжарений дріт унесемо в термостійку посудину з киснем, на дні якої міститься шар води або сухого річкового піску (висловте припущення для чого). Залізо згоряє сліпучим полум’ям та розкидає іскри - розпечені частинки залізної ожарини:
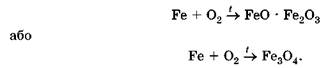
Ця сама реакція відбувається також на повітрі, коли сталь під час механічної обробки сильно нагрівається від тертя (рис. 24.4).

Рис. 24.4. Горіння заліза в кисні: хімія та життя
Як алюміній, так і залізо реагують з галогенами - фтором, хлором, бромом, йодом. Унаслідок реакцій утворюються відповідні галогеніди Алюмінію та Феруму(ІІІ):
![]()
Горіння алюмінію в хлорі супроводжується виділенням теплової та світлової енергії. Після закінчення реакції колбу заповнює дим - розпорошений алюміній хлорид (рис. 24.5.1). Так само бурхливо відбувається реакція алюмінію з бромом (рис. 24.5.2). Реакція алюмінію з йодом каталітична. Аби вона почалася, достатньо добавити кілька крапель води до суміші алюмінієвого порошку з йодом (рис. 24.4.3).

Рис. 24.5. Взаємодія алюмінію з галогенами - хлором (1), бромом (2), йодом (3)
Взаємодія заліза з хлором супроводжується утворенням густого бурого диму - зависі дрібних кристаликів ферум(ІІІ) хлориду в повітрі (рис. 24.6):
Fe + Cl2 → 4· FeCl3; ΔΗ < 0.

Рис. 24.6. Горіння заліза в хлорі
Реакції алюмінію та заліза з іншими неметалами. За нагрівання алюміній реагує із сіркою, азотом, вуглецем:
![]()
Залізо також реагує із цими неметалами за нагрівання. Наприклад, унаслідок реакції заліза із сіркою утворюється ферум(ІІ) сульфід (складіть хімічне рівняння цієї реакції, використавши метод електронного балансу)1.
1 Залізо з вуглецем, бором, силіцієм, фосфором за нагрівання утворює сполуки нестехіометричного складу.
Цікаво і пізнавально
Французький хімік, аптекар та лікар Нікола Лемері 1673 року спостерігав реакцію, перебіг якої нагадував виверження вулкана. Він змішав залізні ошурки та порошкоподібну сірку й доторкнувся до суміші сильно нагрітою скляною паличкою. За кілька секунд із суміші почали вилітати частинки чорного кольору, а сама вона сильно збільшилася в об’ємі й так розжарилася, що засвітилася.
Взаємодія з водою. До її дії алюміній стійкий навіть за нагрівання. Це зумовлено тим, що його поверхня вкрита захисною плівкою алюміній оксиду. Очищений від неї алюміній активно взаємодіятиме з водою.
Аl + Н2О = Αl(ΟΗ)3↓ + H2↑.
Залізо реагує з водою за високої температури: витискує з перегрітої водяної пари2 водень і перетворюється на залізну ожарину:
![]()
2 Пара, нагріта до температури, що перевищує температуру кипіння за певного тиску.
• Проаналізуйте рівняння оборотної реакції заліза з перегрітою водяною парою й поясніть, чи можна змістити рівновагу в ній, змінивши тиск.
Крім того, у вологому повітрі під упливом води та кисню залізо ржавіє. Унаслідок низки реакцій утворюється суміш сполук Феруму характерного бурого кольору (рис. 24.7).

Рис. 24.7. Іржа їсть залізо...
З кислотами й солями в їхніх водних розчинах реагують як алюміній, так і залізо. Унаслідок реакцій з кислотами-неокисниками утворюються солі алюмінію, феруму(ІІ) і водень, а внаслідок реакцій із солями менш активних металів - солі алюмінію та феруму(ІІ) і менш активний метал.
• Скориставшись рядом активності металів, визначте, з-поміж реакцій, схеми яких наведено далі, ті, що можливі. Перетворіть схеми реакцій на хімічні рівняння методом електронного балансу.
Al + НСl →; Al + H2SO4 →; Al + CuCl2 →; Al + Na2SO4 →;
Fe + HCl →; Fe + H2SO4 →; Fe + CuSO4→; Fe + ZnSO4 →.
Про застосування алюмінію та заліза, інших металів і сплавів на їхній основі ви дізнаєтеся з наступного параграфа.
https://www.youtube.com/watch?v=TgRRv968KXsDD
https://www.youtube.com/watch?v=AppyhWb06b8D
https://www.youtube.com/watch?v=KB_Nxay72ws
ПРО ГОЛОВНЕ
• Фізичні властивості алюмінію та заліза - властивості типових металів.
• Алюміній та залізо виявляють відновні властивості в реакціях з неметалами, водою та кислотами й солями у водних розчинах.
Перевірте себе
- 1. Перетворіть розповідні речення в рубриці ПРО ГОЛОВНЕ на питальні. Чи можете ви відповісти на ці запитання без допомоги підручника?
Застосуйте свої знання й уміння
- 2. Складіть порівняльну таблицю «Фізичні властивості заліза та алюмінію».
- 3. Порівняйте хімічні властивості заліза та алюмінію. Відповідь оформте як діаграму Венна.
- 4. Поміркуйте й поясніть, чому: а) готувати й зберігати кислу їжу та напої в алюмінієвому посуді небезпечно для здоров’я; б) чавунний посуд після миття потрібно відразу висушити; в) вода в алюмінієвій каструлі закипає швидше, ніж у сталевій; г) під час смаження на алюмінієвій пательні не варто перемішувати страву ножем або виделкою; д) яку посудину доцільно взяти для розчинення мідного купоросу (купрум(ІІ) сульфату пентагідрату) - алюмінієву, залізну чи поліетиленову.
- 5. Відполіровану залізну пластинку вкрили шаром парафіну. Після застигання парафіну гострим шилом продряпали на ньому рисунок і в борозенки в парафіні піпеткою налили спиртовий розчин йоду. Через певний час шар парафіну зняли. Спрогнозуйте результати досліду й поясніть їх за допомогою хімічного рівняння, узявши до уваги, що утвориться сполука Феруму(ІІІ). Висловте припущення, для чого можна використати цю хімічну реакцію в побуті.
Творча майстерня
- 6. Створіть реальну або віртуальну колекцію «Залізо та алюміній у моєму побуті».
Коментарі (0)