Кислоти
- 15-11-2023, 05:59
- 284
11 клас , Хімія 11 клас Попель, Крикля (рівень стандарту)
§ 21. Кислоти
Матеріал параграфа допоможе вам:
- пригадати склад і назви оксигеновмісних кислот;
- розширити свої знання про хімічні властивості сульфатної та нітратної кислот;
- зрозуміти причини виникнення кислотних опадів.
Склад і назви сполук. До класу кислот належить багато сполук — органічних (наприклад, карбонові кислоти R—СООН, амінокислоти R—CH(NH2)—COOH) інеорганічних (оксигеновмісні та безоксигенові кислоти). Залежно від кількості атомів Гідрогену в молекулі кислоти, які під час хімічних реакцій можуть заміщуватися на атоми (точніше — йони) металічного елемента, розрізняють одно- і багатооснoвні кислоти.
• Укажіть основність кожної з кислот — СН3СООН, H2S, HNO3, Н3РО4.
Цікаво знати
Для таких кислот, як НСlО2, НСlО3, відповідних оксидів (Сl2О3, Сl2О5) не добуто.
Кислоти
HnE
HnEOm
R—СООН
При розчиненні у воді галогеноводнів, сірководню утворюються безоксигенові кислоти (§ 19); їх загальна формула — НnЕ.
Оксигеновмісні кислоти є гідратами кислотних оксидів. Загальна формула кислот цього типу — НnEОm. Формули деяких оксигеновмісних кислот наведено в таблиці 8.
Таблиця 8
Формули і назви деяких оксигеновмісних кислот
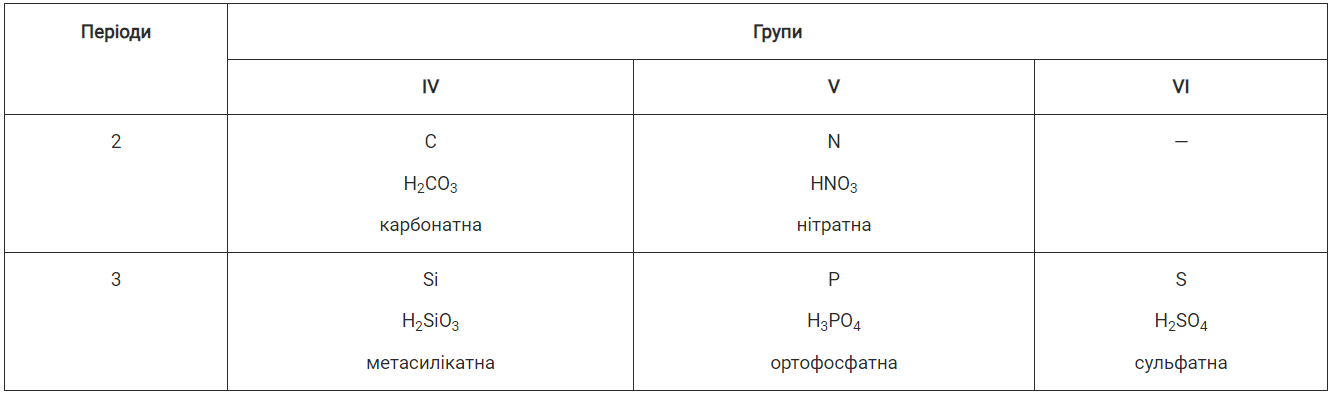
Хімічні назви кислот утворені з двох слів. Другим є слово «кислота», а перше складається з кореня назви елемента, від якого походить кислота, і суфікса -ид або -ід (для безоксигенової кислоти), -aт (якщо ступінь окиснення елемента в кислоті є для нього максимально можливим), -ит або -іт:

Якщо у двох кислотах елемент має один і той самий ступінь окиснення, то перше слово назви кислоти містить ще й префікс — орто- або мета-:
Н3РО4 — ортофосфатна кислота;
НРО3 — метафосфатна кислота.
• Назвіть кислоту, в якій Нітроген виявляє ступінь окиснення +3, і запишіть її формулу.
Найважливіші кислоти також мають тривіальні назви; їх найчастіше використовують у промисловості, техніці, економіці, торгівлі, побуті. Кислоту H2SO4 називають сірчаною, HNO3 — азотною, Н3РО4 — фосфорною, СН3СООН — оцтовою.
Систематичні назви органічних кислот походять від назв вуглеводнів (метанова кислота, етанова кислота).
Будова і фізичні властивості. Усі кислоти складаються з молекул. Сульфатна, нітратна, оцтова кислоти — рідини, ортофосфатна, силікатна й амінооцтова — тверді речовини. Карбонатну, сульфітну, нітритну кислоти не добуто; вони розкладаються вже за звичайних умов:
H2SO3 = SO2 + Н2О.
Для кислот характерні невисокі температури кипіння. Неорганічні кислоти, а також карбонові кислоти з невеликими відносними молекулярними масами змішуються з водою в будь-яких співвідношеннях з утворенням розчинів (виняток — нерозчинна кислота H2SiO3). Вищі карбонові кислоти у воді не розчиняються.
Хімічні властивості. Кислоти мають спільні хімічні властивості. Вони дисоціюють у водному розчині з утворенням катіонів Гідрогену, взаємодіють з металами, основними та амфотерними оксидами, основами, амфотерними гідроксидами, солями.
За здатністю до електролітичної дисоціації кислоти поділяють на сильні, середньої сили та слабкі (форзац II). Сильними кислотами є, зокрема, нітратна і сульфатна; більшість їхніх молекул розпадається на йони:
HNO3 ⇄ H+ + NO-3;
H2SO4 ⇄ H+ + HSO-4;
HSO-4 ⇄ H+ + SO2-4.
Дисоціація сульфатної кислоти за першою стадією в розбавленому розчині відбувається майже повністю, а за другою — частково, однак у йонно-молекулярних рівняннях її за традицією записують сукупністю йонів![]()
Цікаво знати
Нітратну кислоту добували і використовували ще алхіміки у XVII ст.
Реакції з металами. Більшість кислот взаємодіє з металами з утворенням солей і виділенням водню. Ви знаєте, що «витісняти» водень із кислот здатні метали, розміщені в ряду активності ліворуч від нього.
Сульфатна і нітратна кислоти взаємодіють майже з усіма металами. Склад продуктів відповідних реакцій залежить від хімічної активності металу і концентрації кислоти в розчині.
Оскільки метал завжди виступає відновником, то кислота виконує роль окисника й відновлюється. У молекулі![]() можуть відновитися (знизити ступінь окиснення) два елементи — Гідроген і Сульфур. Якщо з металом взаємодіє розбавлена сульфатна кислота, то відновлюється Гідроген. Продукти цієї реакції — сульфат металічного елемента і водень:
можуть відновитися (знизити ступінь окиснення) два елементи — Гідроген і Сульфур. Якщо з металом взаємодіє розбавлена сульфатна кислота, то відновлюється Гідроген. Продукти цієї реакції — сульфат металічного елемента і водень:
Zn + H2SO4 (розб.) = ZnSO4 + H2↑.
Із розбавленою сульфатною кислотою не реагують мідь (мал. 53, а), ртуть, золото, платина, інші хімічно пасивні метали.
Якщо реагентом є концентрована сульфатна кислота, то відновлюється Сульфур. Із концентрованою кислотою реагують також метали, які розміщені в ряду активності після водню (крім золота і платини). Чим активніший метал, тим сильніше відновлюється Сульфур. Малоактивні метали відновлюють кислоту![]() (мал. 53, б), а дуже активні — до
(мал. 53, б), а дуже активні — до![]()
Cu + H2SO4(конц.) → CuSO4 + SO2↑ + Н2О;
Mg + H2SO4(конц.) → MgSO4 + H2S↑ + H2O.
• Складіть схеми окиснення, відновлення й доберіть коефіцієнти методом електронного балансу.

Мал. 53. Відношення міді до розбавленої (а) і концентрованої сульфатної кислоти (б)
У разі участі в реакції металу середньої активності утворюється сірка або одночасно відбуваються дві реакції — з утворенням H2S і S чи S та SO2.
Нітратна кислота взаємодіє майже з усіма металами, за винятком найпасивніших — золота, платини. Під час цих реакцій водень не виділяється. Причина полягає в тому, що атом Нітрогену в ступені окиснення +5, який міститься в молекулі HNO3, виявляє більшу здатність приєднувати електрони, ніж атом Гідрогену в ступені окиснення +1. Отже, окисником у нітратній кислоті є Нітроген, а не Гідроген.
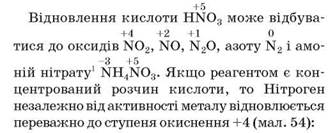
Pb + 4HNO3 (конц.) = Pb(NO3)2+ 2NO2↑ + 2Н2О.

Мал. 54. Взаємодія концентрованої нітратної кислоти зі свинцем
1 Амоніак не утворюється через реакцію NH3 + HNO3 = NH4NO3.
У разі використання розбавленого розчину кислоти її відновлення відбувається як мінімум до нітроген(ІІ) оксиду (HNO3 → NO). Чим активніший метал і чим менша концентрація кислоти в розчині, тим істотніше знижується ступінь окиснення Нітрогену2. Проілюструємо два крайні випадки реакціями з міддю (пасивний метал) і магнієм (активний метал):
Cu + HNO3 (помірно розб.) → Cu(NO3)2 + NO↑ + Н2О;
Mg + HNO3 (дуже розб.) → Mg(NO3)2+ NH4NO3 + Н2О.
• Перетворіть схеми реакцій на хімічні рівняння.
2 Часто утворюються суміші продуктів відновлення Нітрогену.
Реакції зі сполуками основної та амфотерної природи. Сильні неорганічні кислоти (хлоридна, сульфатна, нітратна) взаємодіють з основними оксидами і основами, амфотерними оксидами і гідроксидами. Такі хімічні перетворення вам добре відомі.
• Складіть рівняння реакцій сульфатної кислоти з купрум(ІІ) оксидом, алюміній гідроксидом.
Кислотні опади. Трапляються випадки, коли дощова вода містить домішки кислот. Молекули кислот з’являються в атмосфері внаслідок хімічних реакцій.
За високої температури, яка досягається при згорянні палива і пального, починають взаємодіяти головні компоненти повітря — азот і кисень:
![]()
Нітроген(ІІ) оксид, що утворюється, швидко реагує з киснем за звичайних умов:
2NO + О2 = 2NO2.
Сульфур(ІV) оксид потрапляє в повітря при спалюванні вугілля1, а також із газовими викидами під час випалювання сульфідних руд:
![]()
1 Сполуки Сульфуру є домішками у вугіллі.
Оксиди NO2 і SO2 взаємодіють з водою, крапельки якої наявні в атмосфері. Продуктами цих реакцій є нітратна, нітритна і сульфітна кислоти, а остання ще й окиснюється киснем у сульфатну кислоту:
2H2SO3 + О2 = 2H2SO4.
Невелика кількість цих кислот разом із дощем і снігом потрапляє на земну поверхню.
Кислотні опади завдають значної шкоди довкіллю. Вони зменшують урожаї сільськогосподарських культур, спричиняють різні захворювання у тварин і людей, руйнування будівель і пам’ятників із мармуру (мал. 55) та вапняку, корозію металевих виробів.

Мал. 55. Наслідки кислотних опадів
Запобігти утворенню оксидів Нітрогену можна, знизивши температуру згоряння палива і пального. З метою зменшення викидів сірчистого газу в атмосферу теплоелектростанціями перевагу віддають паливу з меншим вмістом Сульфуру, а відпрацьовані гази очищають від сульфур(ІV) оксиду пропусканням крізь водну суспензію кальцій гідроксиду чи розпилюють у них негашене вапно.
ВИСНОВКИ
Оксигеновмісні кислоти є гідратами кислотних оксидів. Вони складаються з молекул.
Найважливіші оксигеновмісні кислоти — сульфатна H2SO4 і нітратна HNO3. Це сильні кислоти, які взаємодіють з металами, сполуками основної та амфотерної природи, солями.
Під час реакцій розбавленої сульфатної кислоти з металами виділяється водень, а концентрована кислота взаємодіє з ними з утворенням сульфур(ІV) оксиду, сірки або сірководню. Внаслідок реакцій нітратної кислоти з металами водень не виділяється, а утворюються оксиди Нітрогену, азот або амоній нітрат. Відновлення Сульфуру та Нітрогену залежить від активності металу, а в разі нітратної кислоти — ще й від її концентрації в розчині.
Утворення в атмосфері кислот унаслідок взаємодії оксидів Сульфуру і Нітрогену з водою спричиняє кислотні опади, які завдають шкоди довкіллю.
- 155. Укажіть правильну відповідь.
Нітратній кислоті відповідає оксид:
а) NO;
б) N2O3;
в) N2O5;
г) N2O.
- 156. Яких частинок більше в розбавленому розчині сульфатної кислоти:
а) молекул кислоти чи йонів HSO-4;
б) йонів SO2-4 чи йонів H+?
- 157. Допишіть схеми реакцій і складіть хімічні рівняння:
a) H2SO4+ МnО →
H2SO4+ Fe(OH)3 →
б) H2SO4+ Pb(NO3)2 →
H2SO4 + NaF →
- 158. Складіть рівняння тих реакцій, які можливі:
a) Ag + H2SO4(розб.) →
Ag + H2SO4(конц.) →
б) Mg + H2SO4(розб.) →
Ζn + H2SO4(конц.) →
- 159. Знайдіть відповідність між елементом і його функцією в реакції нітратної кислоти з металом:
1) Гідроген;
2) Нітроген;
3) Оксиген;
4) металічний елемент;
а) окисник;
б) відновник;
в) не змінює ступеня окиснення.
- 160. Допишіть схеми реакцій і складіть хімічні рівняння:
a) HNO3 + Li2O →
HNO3 + Sr(OH)2 →
б)HNO3 + Fe(OH)3 →
HNO3 + ZnCO3 →
- 161. Складіть рівняння реакцій між:
а) концентрованою нітратною кислотою і сріблом;
б) дуже розбавленою нітратною кислотою і кальцієм.
- 162. Чому, на ваш погляд, до сполук, які спричиняють утворення кислотних опадів, не зараховують кислотний оксид СО2?
- 163. Співвідношення мас сульфатної кислоти і води в деякому розчині становить 1 : 7. Обчисліть масову частку кислоти в розчині. (Усно.)
- 164. У яку масу води потрібно додати 60 г концентрованої сульфатної кислоти з масовою часткою H2SO4 98 %, щоб утворився розчин із масовою часткою H2SO4 20 %?
- 165. У результаті взаємодії 5,3 г натрій карбонату з достатньою кількістю нітратної кислоти добуто 8,1 г натрій нітрату. Визначте відносний вихід цього продукту реакції.
Коментарі (0)