Залізо: фізичні й хімічні властивості
- 15-11-2023, 22:19
- 301
11 клас , Хімія 11 клас Ярошенко (рівень стандарту)
§ 24. Залізо: фізичні й хімічні властивості
ФЕРУМ ЯК ХІМІЧНИЙ ЕЛЕМЕНТ. Металічний елемент Ферум Fe (протонне число 26) розташований у побічній підгрупі VІІІ групи. Зверніть увагу на особливості елементного складу цієї підгрупи. У кожному періоді вона представлена не одним, а трьома металічними елементами. У 4 періоді це металічні елементи Ферум Fe, Кобальт Со і Нікол (Нікель) Ni. Радіуси їх атомів, температури плавлення й кипіння, густини близькі за значеннями, а утворені ними прості речовини схожі за хімічними властивостями. Цим і пояснюється розташування Феруму, Кобальту і Ніколу тріадою у побічній підгрупі VІІІ групи.
Вам відома електронна формула атома Феруму:
26Fe 1s22s22p63s23p63d64s2.
Вона свідчить, що зовнішній (четвертий) енергетичний рівень атома Феруму має типову для металічних елементів будову — містить два s-електрони. Тоді чому Ферум розміщений у VІІІ групі і не належить до s-елементів? Відповідь криється у будові третього енергетичного рівня електронної оболонки його атома. До Кальцію включно цей рівень складався лише з s- та р-електронів. В електронній оболонці атома Феруму на d-підрівні третього енергетичного рівня перебуває шість електронів. А в сумі з двома електронами четвертого енергетичного рівня їх вісім. Цим і пояснюється розташування Феруму у VІІІ групі. Чи міг він посісти місце в головній підгрупі цієї групи? Ні, тому що в елементів головних підгруп кількість електронів на зовнішньому енергетичному рівні дорівнює номеру групи (виняток становить Гідроген, якщо вважати його елементом VІІ групи), і валентні електрони розташовані лише на зовнішньому енергетичному рівні.
У сполуках Ферум проявляє здебільшого ступені окиснення +2 і +3, хоча за певних умов можна добути речовини з вищими ступенями окиснення.
ПОШИРЕННЯ ФЕРУМУ В ПРИРОДІ. За поширенням у природі йому належить четверте місце, а серед металічних елементів — друге. Ферум міститься переважно у складі оксидів, сульфідів, карбонатів, що становлять основу його мінералів і руд.
Поклади залізних руд утворюють мінерали магнетит (магнітний залізняк) Fe3O4 (мал. 54, а), лимоніт (бурий залізняк) Fe2O3 · nН2О, гематит (червоний залізняк) Fe2O3 (мал. 54, б), сидерит (залізний шпат) FeCO3, пірит (залізний колчедан) FeS2 (мал. 54, в).

Мал. 54. Залізорудні мінерали: а — магнетит; б — гематит; в — пірит
Проста речовина залізо, утворена атомами Феруму, у природі трапляється рідко, переважно в уламках метеоритів, що досягли поверхні Землі. У незначній кількості Ферум входить до складу клітин організмів. В організмі дорослої людини близько 4-5 г Феруму, з яких 65 % перебуває у складі гемоглобіну крові.
• Поцікавтесь, які харчові продукти дієтологи і лікарі радять вживати для підтримання вмісту Феруму в організмі людини.
Надра нашої держави містять великі запаси залізних руд. Найбільші родовища, на базі яких здійснюють промислове виробництво заліза і його сплавів, відкриті у Криворізькому, Кременчуцькому та Білогірському залізорудних басейнах.
ФІЗИЧНІ ВЛАСТИВОСТІ ЗАЛІЗА. Залізо — сріблясто-білий із сіруватим відтінком метал (у порошкоподібному стані блиск втрачається, колір стає сірувато-чорним). Залізо має густину 7,87 г/см3 і температуру плавлення 1539 °С. Під час накалювання метал легко прокатується, кується. Наші прадіди використовували цю його властивість для виготовлення у кузнях плугів, борін, коліс, сокир, підків, молотків, лопат тощо. Не випадково одними з головних персонажів «Вечорів на хуторі біля Диканьки» М. В. Гоголя та комедії «За двома зайцями» М. П. Старицького є ковалі Вакула та Микола. Традиції ковальства збереглися в Україні подекуди й до наших днів.
Залізо та його сплави притягуються магнітом і легко намагнічуються у магнітному полі, є добрими провідниками струму й тепла. На підтвердження здатності заліза намагнічуватися піднесіть магніт до купки залізних скріпок, і ви побачите, що скріпки прикріпилися не лише до магніту, а й одна до одної на зразок гірлянди (мал. 55).

Мал. 55. Намагнічування заліза
На магнітних властивостях заліза і його сплавів ґрунтується їхнє використання як матеріалу для виготовлення серцевин трансформаторів, вантажопідіймачів, телефонних мембран тощо.
ХІМІЧНІ ВЛАСТИВОСТІ ЗАЛІЗА. Залізо з високим ступенем чистоти не піддається корозії — іржавінню. В Індії у м. Делі близько 16 століть стоїть монолітна колона заввишки 7,21 м, виготовлена майже із чистого (99,72 %) заліза, і вона практично не піддається іржавінню (мал. 56).

Мал. 56. Нержавіюча колона з чистого заліза (м. Делі, Індія)
Учені до цього часу не дійшли остаточної думки про те, як в ті часи отримали залізо такого ступеня чистоти.
Різні домішки збільшують активність заліза в усіх хімічних реакціях.
Подібно до більшості металів залізо окиснюється киснем та іншими неметалами, вступає у реакції заміщення з кислотами і солями менш активних за Ферум металічних елементів, взаємодіє під час нагрівання з водою.
Розглянемо детальніше хімічні властивості заліза.
1. Взаємодія заліза з киснем
Вам уже демонстрували дослід зі згорання заліза в кисні, у якому за лічені секунди тонка залізна голка згорала сліпучим полум'ям, а утворений продукт реакції залізна окалина Fe3O4 поширювався в усі боки, нагадуючи бенгальські вогні:

Як зазначено в дужках, залізна окалина є подвійним оксидом, у ферум(ІІ) оксиді зі ступенем окиснення +2 і +3 у ферум(ІІІ) оксиді.
2. Взаємодія з іншими неметалами

3. Взаємодія з кислотами
Взаємодія заліза з кислотами залежить від температури та концентрації кислоти. Переконатися в цьому можна на такому демонстраційному досліді. У 4 пробірки помістимо по одній ложці залізного порошку. У першу пробірку доллємо 2-3 мл розбавленої хлоридної кислоти й через невеликий проміжок часу спостерігатимемо появу пухирців газу. Для прискорення реакції вміст пробірки можна підігріти.
У другу пробірку наллємо стільки ж розчину розбавленої сульфатної кислоти. Результати спостереження будуть аналогічні з першою пробіркою.
Складемо рівняння реакцій:
![]()
Додавання до третьої пробірки концентрованої сульфатної кислоти H2SO4 і в четверту пробірку — концентрованої нітратної кислоти HNO3, підтвердило експериментально знання, здобуті з § 21, — залізо не взаємодіє з концентрованими нітратною й сульфатною кислотами.
Попрацюйте групами
Завдання 1. Назвіть продукти і визначте типи реакцій 1-6.
Завдання 2. Визначте ступені окиснення елементів у речовинах.
Завдання 3. Окисні чи відновні властивості виявляє залізо в цих реакціях?
Завдання 4. Як будете доводити, що в реакціях з хлоридною й розбавленою сульфатною кислотами виділяється водень, а не інший газ?
Зверніть увагу! У реакціях з розбавленими хлоридною та сульфатною кислотами залізо утворює сіль Феруму(2+), тоді як у реакції з хлором утворюється сіль Феруму(3+).
4. Взаємодія з водою
З власного досвіду кожен з вас знає, що залізо з водою не взаємодіє. А інакше, навіщо тоді виготовляти з нього днища кораблів, кухонне приладдя тощо? Та під час пропускання парів води над нагрітим порошком заліза відбувається реакція, що супроводжується утворенням залізної окалини Fe3O4 і водню:
![]()
Як бачите, залізо відновлює Гідроген до водню.
5. Взаємодія заліза із солями
Атоми Феруму заміщують йони менш активного металічного елемента в розчині його солі. Приклад такої реакції вам відомий: у розчині мідного купоросу на залізні предмети (цвяхи, скріпки, кнопки тощо) досить швидко осідає відновлена мідь, надаючи їм червоно-цегляного кольору (мал. 57):
![]()
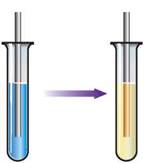
Мал. 57. Дія розчину купрум(ІІ) сульфату (мідного купоросу) на залізний предмет
ЯКІСНІ РЕАКЦІЇ З ВИЗНАЧЕННЯ В РОЗЧИНАХ ЙОНІВ ФЕРУМУ(2+), ФЕРУМУ(3+), ШЛЯХОМ ОСАДЖЕННЯ ЇХ ЛУГАМИ. Розчинними у воді складними речовинами, що дисоціюють з утворенням катіонів Феруму(2+) і Феруму(3+), є їхні солі. Вивчивши властивості солей і лугів, ви дізнались, що реакції між представниками цих класів неорганічних сполук відбуваються за умови утворення нерозчинного гідроксиду або солі.
• Пригадайте, що натрій гідроксид, кальцій гідроксид білого кольору, з водою вони утворюють безбарвні розчини.
Ферум(ІІ) гідроксид і ферум(ІІІ) гідроксид — нерозчинні у воді речовини. До того ж їхній колір відмінний від кольору більшості гідроксидів.
Ферум(ІІІ) гідроксид Fe(OH)3 — речовина іржаво-коричневого кольору.
Ферум(ІІ) гідроксид Fe(OH)2 — речовина зеленувато-білого кольору, що після утворення поступово набуває іржаво-коричневого забарвлення через подальше окиснення катіонів Феруму(2+) киснем у присутності води до катіонів Феруму(3+):
4Fe(OH)2+ О2 + 2H2O = 4Fe(OH)3.
Наведеною інформацією можна скористатися для визначення в розчинах йонів Феруму(2+) та Феруму(3+).

Знання цих якісних реакцій допоможе вам розпізнавати сполуки Феруму(2+) і Феруму(3+) в розчинах.
Хімія — це життя: сторінка природодослідника
Лабораторні досліди 4-6
Виявлення в розчині катіонів Феруму(2+), Феруму(3+), Барію
Вам знадобляться: пробірки, штативи для пробірок, розчини солей Феруму(2+), Феруму(3+), Барію, солей сульфатної кислоти, лугу.
Завдання 1. Проведіть реакцію між розчинами солі Феруму(2+) і лугу. Спостерігайте за явищем, що супроводжує цю реакцію, поясніть його. Запишіть результати спостереження у зошит. Складіть молекулярне, повне і скорочене йонні рівняння проведеної реакції.
Завдання 2. Проведіть реакцію між розчинами солі Феруму(3+) і лугу. Спостерігайте за явищем, що супроводжує цю реакцію, поясніть його. Запишіть результати спостереження у зошит. Складіть молекулярне, повне і скорочене йонні рівняння проведеної реакції.
Завдання 3. Проведіть реакцію між розчинами солей Барію і сульфатної кислоти. Спостерігайте за явищем, що супроводжує цю реакцію, поясніть його. Запишіть результати спостереження у зошит. Складіть молекулярне, повне і скорочене йонні рівняння проведеної реакції.
У висновку зазначте, за допомогою яких якісних реакцій можна виявити в розчині катіони Fe2+, Fe3+, Ва2+.
Знаємо, розуміємо
- 1. У чому полягають особливості будови атома Феруму та його місце в періодичній системі порівняно з Алюмінієм?
- 2. Поясніть, на підставі чого Ферум помістили у VIII групу періодичної системи.
- 3. Схарактеризуйте фізичні властивості заліза.
- 4. Перелічіть хімічні властивості заліза. До активних чи малоактивних речовин належить залізо?
Застосовуємо
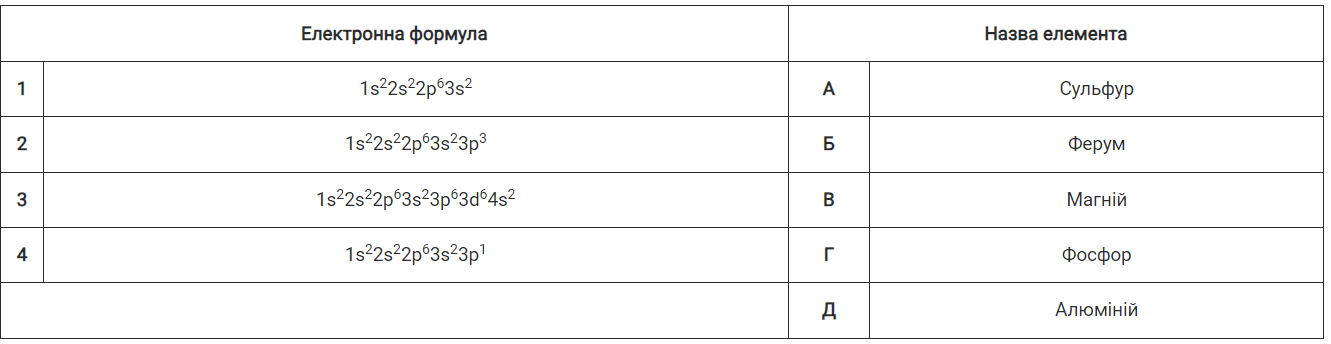
- 1. Установіть відповідність між електронними формулами атомів і назвами хімічних елементів.
- 2. Розташуйте формули речовин за збільшенням ступеня окиснення Феруму: Fe(OH)3, Fe, FeCl2.
- 3. Чи належать розглянуті в параграфі якісні реакції з визначення в розчинах йонів Феруму(2+), Феруму(3+) до окисно-відновних? Відповідь обґрунтуйте.
- 4. Порівняйте об'єм водню (н. у.), що виділяється під час взаємодії заліза масою 16,8 г з достатньою кількістю: а) хлоридної кислоти; б) води.
- 5. Обчисліть масу ферум(ІІІ) хлориду, що утворився в реакції заліза кількістю речовини 0,2 моль з достатньою кількістю хлору.
- 6*. Залізну пластинку масою 100 г занурили в розчин купрум(ІІ) сульфату масою 200 г. Після завершення реакції маса пластинки збільшилась на 0,2 г. Обчисліть масову частку солі у розчині, взятому для реакції.
Коментарі (0)