Білки: будова та властивості
- 23-09-2021, 23:23
- 957
10 Клас , Біологія 10 клас Балан, Вервес, Поліщук (рівень стандарту, академічний рівень)
§ 9. Білки: будова та властивості
Пригадайте: приклади макромолекул, мономерів і біополімерів? Яка роль білків у житті організмів? Який хімічний склад гемоглобіну і ферментів, які їхні функції?
Серед органічних сполук білки відіграють провідну роль. Вони часто переважають у клітинах і в кількісному відношенні: приміром, у клітинах тварин становлять до 40-50 % сухої маси, а рослин - до 20-35 %.
• Будова білків. Білки - високомолекулярні нітрогеновмісні біополімери, мономерами яких є залишки амінокислот. Амінокислоти - це органічні кислоти, що містять аміногрупу (-NH2), якій притаманні лужні властивості, та карбоксильну групу (-СООН) з кислотними властивостями. Ці групи, як і атом Гідрогену, зв’язані з одним і тим самим атомом Карбону. Є у складі амінокислот й специфічні для кожної з них частини. Їх називають радикалами (R-групами). Загальна формула амінокислоти має вигляд:
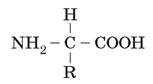
Загалом у тканинах живих істот трапляється понад 100 амінокислот, але до складу білків входять лише 20 основних, які зустрічаються майже в усіх білках. Крім того, неосновні амінокислоти, кожна з яких - похідна однієї з основних, є компонентами лише окремих типів білків.
Наприклад, білок колаген, який входить до складу сполучної тканини, містить гідроксипролін (похідну амінокислоти проліну); у протромбіні (одному з білків, які відповідають за процес зсідання крові) знайдено карбоксиглутамінову кислоту (похідну глутамінової кислоти) тощо.
У таблиці 9.1 (с. 52) наведено повні та скорочені назви основних амінокислот. Різні комбінації лише 20 амінокислот забезпечують нескінченну різноманітність білкових молекул (число можливих варіантів - близько 2 • 1018). Зокрема, в організмі людини трапляється понад 5 млн типів білкових молекул. Молекула кожного певного білка характеризується специфічними складом і послідовністю амінокислотних залишків, які надають їй неповторних функціональних властивостей.
Існують різні класифікації амінокислот. Зокрема, амінокислоти поділяють на замінні та незамінні. Замінні амінокислоти організму людини і тварин здатні синтезуватися з продуктів обміну речовин. Натомість, незамінні амінокислоти в організмах людини і тварин не утворюються, а надходять разом з їжею. Ці амінокислоти синтезують рослини, гриби, бактерії. Білки, які містять усі незамінні амінокислоти, називають повноцінними, на відміну від неповноцінних, до складу яких не входять окремі незамінні амінокислоти. Слід зазначити, що для різних видів тварин і людини набір незамінних амінокислот неоднаковий, до того ж він може змінюватися з віком. Наприклад, аргінін або гістидин - замінні для дорослих і незамінні для дітей. Відсутність або нестача однієї чи кількох незамінних амінокислот спричиняють негативний баланс Нітрогену в організмі, порушення біосинтезу білків, гальмування росту й розвитку.
Залишки молекул амінокислот у складі білків сполучені між собою міцним ковалентним зв’язком, який виникає між карбоксильною групою однієї амінокислоти та аміногрупою іншої. Цей тип зв’язку називають пептидним (від грец. пептос - зварений). Завдяки такому міцному зв’язку утворюється сполука, яка складається із залишків двох амінокислот - дипептид. Структури, які складаються з великої кількості залишків амінокислот (від 6-10 до декількох десятків), належать до поліпептидів (пептидний зв’язок позначено кольором):

Поліпептиди з високою молекулярною масою (від 6000 до кількох мільйонів) називають білками. Вони складаються з одного або декількох поліпептидних ланцюгів і можуть містити до кількох тисяч амінокислотних залишків.
Таблиця 9.1
Назви основних амінокислот та їхні скорочені позначення
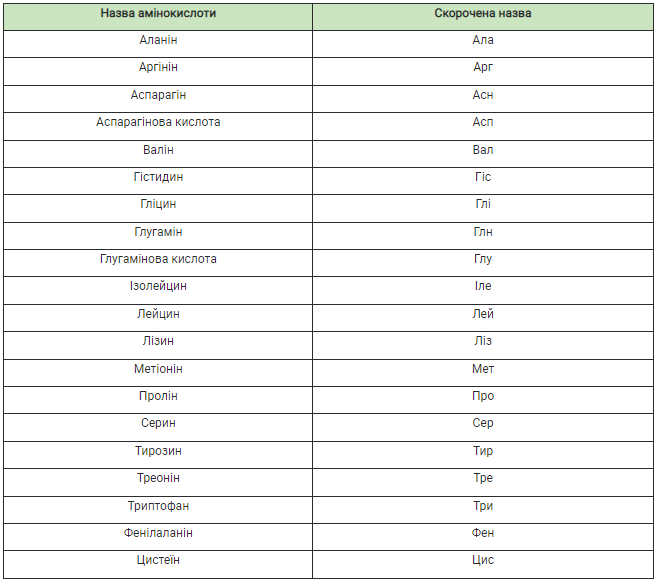
Назва амінокислоти часто відображає назву субстрату, з якого її було виділено, або певні властивості та ін. Наприклад, аспарагін вперше виявлено в рослині аспарагусі (холодок), гліцин названо завдяки солодкому присмаку (від грец. глікос - солодкий).
• Рівні просторової організації білків. Відомо чотири рівні просторової організації, або конформації, білків: первинний, вторинний, третинний і четвертинний (мал. 9.1).
Первинну структуру білків визначає певна послідовність амінокислотних залишків, з’єднаних за допомогою пептидних зв’язків. Саме первинна структура і визначає властивості та функції тієї чи іншої білкової молекули. Часто молекула білка у вигляді такого ланцюга не придатна до виконання свого призначення. Для цього вона, наприклад, має повністю або частково закрутитися у спіраль, тобто набути вторинної структури завдяки водневим зв’язкам. Такі зв’язки виникають між атомами Гідрогену NH-групи одного витка спіралі та Оксигену СО-групи іншого витка спіралі. Хоча ці зв’язки значно слабші за пептидні, однак разом вони формують досить міцну структуру.

Мал. 9.1. Рівні просторової організації білкових молекул: 1 - первинний; 2 - вторинний; 3 - третинний; 4 - четвертинний
Третинна структура зумовлена здатністю поліпептидної спіралі закручуватися певним чином у грудку, або глобулу, завдяки зв’язкам, які виникають між залишками амінокислоти цистеїну (так звані дисульфідні зв’язки). Підтримання третинної структури забезпечують гідрофобні, електростатичні та інші взаємодії, а також водневі зв’язки (мал. 9.2). Гідрофобні взаємодії - це сили тяжіння між неполярними молекулами або між неполярними ділянками молекул у водному середовищі. Гідрофобні залишки усяких амінокислот у водному розчині зближуються, наче «злипаються», та стабілізують структуру білка.
Електростатичні зв’язки виникають між негативно та позитивно зарядженими радикалами залишками амінокислот.
Четвертинна структура білків виникає, коли об’єднуються кілька глобул. Наприклад, молекула гемоглобіну складається з чотирьох залишків молекул білка міоглобіну.

Мал. 9.2. Зв’язки, які підтримують конформації білкової молекули: 1 - водневі; 2 - дисульфідні; З - йонні взаємодії; 4 - гідрофобні взаємодії
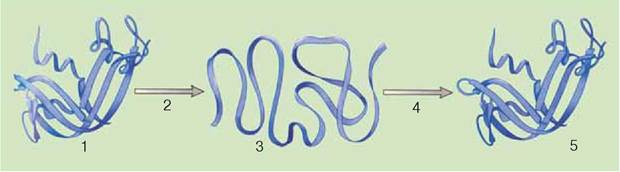
Мал. 9.3. Денатурація (2) та ренатурація (4) білкової молекули: 1, 5 - активні молекули білка; 3 - неактивна молекула білка
Залежно від хімічного складу білки поділяють на прості та складні. Прості, або протеїни, складаються лише з амінокислотних залишків, а складні, або протеїди, у молекулах містять також небілкові компоненти - залишки ортофосфатної та нуклеїнових кислот, вуглеводів, ліпідів, атоми Феруму, Цинку, Купруму тощо. Складні білки називають глікопротеїдами (сполуки з вуглеводами), ліпопротеїдами (з ліпідами), нуклеопротеїдами (з нуклеїновими кислотами) тощо. Багато білків утворюють складні комплекси з пігментами - забарвленими у різні кольори органічними сполуками.
• Властивості білків. Функціональні властивості білків зумовлені їхнім амінокислотним складом і просторовою структурою. За формою молекул розрізняють фібрилярні (ниткоподібні) та глобулярні (кулясті) білки. Фібрилярні білки зазвичай нерозчинні у воді й виконують структурну (наприклад, кератин входить до складу волосся людини або шерсті тварин) або рухову (м’язові білки) функції. Натомість глобулярні білки здебільшого водорозчинні та виконують інші функції: наприклад, гемоглобін забезпечує транспорт газів, пепсин - розщеплення білків їжі, імуноглобуліни (антитіла) - захисну. Глобулярні білки менш стійкі (пригадайте з власного досвіду: білок курячих яєць навіть за незначного підвищення температури легко змінює свою структуру).
Одна з основних властивостей білків - їхня здатність під впливом різних чинників (дія концентрованих кислот і лугів, важких металів, високої температури тощо) змінювати свою структуру і властивості. Процес порушення природної структури білків, який супроводжується розгортанням білкової молекули без зміни її первинної структури, називають денатурацією (мал. 9.3). Здебільшого денатурація необоротна. Але якщо на початкових стадіях денатурації припиняється дія чинників, що призвели до неї, білок може відновити свій початковий стан. Це явище називають ренатурацією. У живих організмів оборотна денатурація часто пов’язана з виконанням певних функцій білковими молекулами: забезпеченням рухів, передачею до клітини сигналів з навколишнього середовища, прискоренням біохімічних реакцій тощо. Необоротний процес руйнування первинної структури білків називають деструкцією.
Ключові терміни та поняття. Білки, поліпептиди, денатурація, ренатурація, деструкція.
Коротко про головне
- Білки - високомолекулярні біополімери, мономерами яких є залишки амінокислот. Двадцять основних амінокислот можуть сполучатися між собою у різних поєднаннях за допомогою особливого типу ковалентного (пептидного) зв’язку.
- Дипептид складається із залишків двох амінокислот, поліпептид - із залишків від 6-10 до кількох десятків амінокислот; поліпептиди з молекулярною масою понад 6000 називають білками.
- Відомо чотири рівні просторової організації білків: первинний, вторинний, третинний і четвертинний. Первинну структуру білків визначає певна послідовність різних типів амінокислотних залишків. Вторинна структура характеризується тим, що білкова молекула повністю або частково закручується в спіраль завдяки водневим зв’язкам, які виникають між атомами Гідрогену NH-групи одного витка спіралі та Оксигену СО-групи іншого. Третинна структура часто нагадує грудку (глобулу) та існує завдяки дисульфідним та іншим типам зв’язків. Четвертинна структура виникає шляхом об’єднання разом кількох глобул; її забезпечують гідрофобні, електростатичні, водневі та інші зв’язки.
- Прості білки, або протеїни, складаються лише з амінокислотних залишків, а складні, або протеїди, у своєму складі мають також сполуки іншої природи.
- Білки здатні до денатурації та ренатурації (зміни та відновлення своєї структури). Необоротний процес руйнування первинної структури білків називають деструкцією.
Запитання для самоконтролю
1. Яка будова амінокислот, поліпептидів та білків? 2. Які амінокислоти називають замінними та незамінними? 3. Як амінокислоти сполучаються в поліпептидний ланцюг? 4. Які білки відносять до простих, а які - до складних? 5. Які є рівні просторової організації білків? 6. Які властивості притаманні білкам? 7. Як властивості білків залежать від їхньої просторової структури?
Поміркуйте
1. Що спільного та відмінного в процесах денатурації та деструкції? 2. Яку роль у житті організмів відіграє здатність молекул білків до денатурації? 3. Чому відсутність в їжі білків тваринного походження негативно впливає на життєдіяльність організму людини?
Коментарі (0)