Білки
- 11-11-2021, 22:58
- 2 415
9 Клас , Біологія 9 клас Шаламов, Носов, Литовченко, Каліберда
§ 3. Білки
Білки — найрізноманітніші органічні компоненти будь-якої клітини
Як ми вже з’ясували, масова частка води в живих організмах найбільша. Тобто органічних речовин менше, але вони більш різноманітні за будовою та біологічною роллю. Назви багатьох із них ви могли чути на уроках біології в попередніх класах. Це, наприклад, вуглеводи, білки, жири. Але й із-поміж цих речовин своїм структурним і функціональним різноманіттям вирізняються білки. Їхні молекули можуть бути будівельним матеріалом, моторами, брати участь у хімічних реакціях і захисті організму, сприймати сигнали, транспортувати інші молекули, а також виконувати безліч біологічних функцій. Про білки йтиметься в цьому параграфі. Білки настільки різноманітні, що лише в організмі людини є близько 60 000 їх видів. А загалом у живій природі їх може налічуватися понад мільярд. У чому ж причина такого різноманіття білків?

Рис. 3.1. Загальна формула амінокислоти
Амінокислоти відрізняються одна від одної своїми R-групами. До їх складу можуть входити гідрофільні та гідрофобні, кислотні й основні, заряджені та незаряджені групи атомів. Таким чином, набір амінокислот у білковій молекулі визначає її фізико-хімічні властивості.
Із формулами окремих амінокислот можна ознайомитися в будь-якому підручнику з біохімії чи тут:

Білки — великі молекули зі складною будовою
Відповідь криється в будові білка. Білок є полімерною молекулою, що складається з мономерних ланок — залишків амінокислот (рис. 3.1), з’єднаних між собою в лінійний1 ланцюжок. До складу таких ланцюжків може входити від 50 до кількох сотень амінокислотних залишків (рис. 3.2). Ці амінокислотні залишки в білкових молекулах різняться. У ході утворення тваринних і рослинних білків до складу їхніх молекул включається 21 різновид амінокислот.
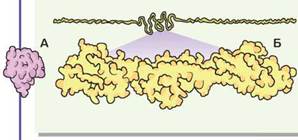
Рис. 3.2. Інсулін (А) та тітин (Б)
Білки різняться за формою й розмірами. На рисунку зображено гормон підшлункової залози інсулін — один із найменших білків, і тітин — один із найбільших білків. Докладніше з різноманіттям форм і розмірів білків та їхніх комплексів можна ознайомитися на сайті Міжнародного банку інформації про білки:

1 Лінійний тут потрібно розуміти як нерозгалужений, тобто такий, що в ньому всі мономери з’єднані послідовно один за одним.

Рис. 3.3. Чотири амінокислотні ланцюжки, різні за довжиною, складом і послідовністю з’єднання
Ланцюжок 1 відрізняється від ланцюжків 2, 3 та 4 за довжиною.
Ланцюжки 2, 3 та 4 мають однакову довжину, але ланцюжок 2 відрізняється від 3 та 4 за складом, а ланцюжки 3 та 4 — тільки послідовністю з’єднання.
Таким чином, білкові молекули відрізняються одна від одної розмірами (кількістю амінокислотних залишків), складом (набором амінокислотних залишків) і послідовністю їх з’єднання (рис. 3.3).
Білкові молекули складно організовані
Отже, білкова молекула є лінійним полімером. Проте такі довгі молекули в організмах укладаються в структуру певної форми. Це досягається завдяки взаємодії різних ділянок білкової молекули одна з одною (рис. 3.4). Тільки набувши певної тривимірної структури, білкова молекула зможе виконувати свою біологічну функцію. Ця структура практично завжди визначається послідовністю амінокислот, але також перебуває під впливом низки факторів навколишнього середовища. Найважливіші з-поміж цих факторів — температура, кислотність і солоність.
Тривимірні структури білків дуже різноманітні, утім найпоширенішими є глобулярні та фібрилярні1 білки. Глобулярні білки зазвичай є розчинними сферичними молекулами. Ці білки, як правило, працюють у розчинах (цитоплазмі, плазмі крові) і виконують транспортні, регуляторні, сигнальні й каталітичні функції. Так, наприклад, альбумін є глобулярним білком, він розчинений у плазмі крові і транспортує гідрофобні молекули по організму. Фібрилярні білки мають паличкоподібну структуру й здебільшого нерозчинні. Вони є структурним матеріалом для побудови внутрішньо- та позаклітинного каркасів. Наприклад, кератин — яскравий представник фібрилярних білків — створює основу епідермісу шкіри та його похідних: волосся, нігтів, кігтів, копит, рогів.
Тривимірна структура, побудована з одного амінокислотного ланцюжка, далеко не завжди функціонально активна. Для виконання своїх функцій таким ланцюжкам треба об’єднуватись у більші надмолекулярні комплекси. Усім відомий білок еритроцитів гемоглобін є саме таким комплексом: він складається із чотирьох глобулярних молекул (рис. 3.5).

Рис. 3.4. Рівні організації білкової молекули
Амінокислотний ланцюжок перетворюється на функціональний білок. 1. Шляхом взаємодії близько розташованих амінокислотних залишків формується локально впорядкована структура. 2. Віддалені ділянки амінокислотного ланцюжка взаємодіють одна з одною, формуючи тривимірну молекулу. 3. У деяких білків кілька амінокислотних ланцюжків об’єднуються, формуючи надмолекулярні комплекси. Етапи 1-3 можуть відбуватися як послідовно, так й одночасно.
1 Від лат. globulus — кулька; fibrilla — волоконце, ниточка.

Рис. 3.5. Будова альбуміну (А), кератину (Б), гемоглобіну (В)
Біологічна роль білків
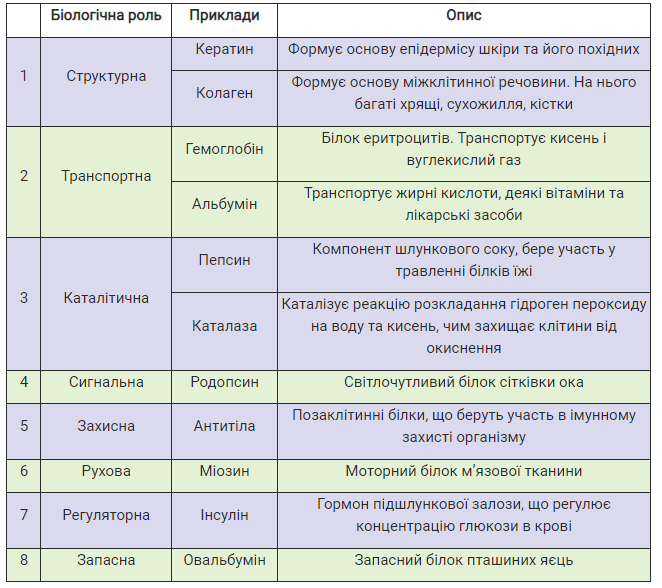
Описуючи будову білків, ми вже порушили питання про їхню біологічну роль. Отже, функції білків дуже різноманітні. Можна сказати, що білки беруть участь у здійсненні майже всіх процесів в організмі. У таблиці 3.1 наведено огляд біологічної ролі білків із прикладами.
Таблиця 3.1. Біологічна роль білків

Олександр Данилевський
Народився 1838 року в Харкові. Навчався в Другій харківській гімназії, потім закінчив медичний факультет Харківського університету. Працював у Харківському й Казанському університетах, Санкт-Петербурзькій імператорській військово-медичній академії, лабораторіях Німеччини, Австрії та Швейцарії. Запропонував теорію будови білкової молекули, довів, що шлунковий сік гідролізує білки, відкрив інгібітори травних ферментів антитрипсин і антипепсин, які запобігають самоперетравленню стінок шлунково-кишкового тракту. Помер 1923 року в Петрограді (нині Санкт-Петербург).

Еміль Фішер
Народився 1852 року в німецькому місті Ойскірхен. Закінчив Страсбурзький університет. Працював у Мюнхенському, Ерлангенському, Вюрцбурзькому й Берлінському університетах. Фішер вивчав хімію білків і відкрив пептидний зв’язок, установивши, що саме з допомогою цього зв’язку амінокислотні залишки об’єднані в білкову молекулу. Ось що писав дослідник: «Оскільки білкові речовини тією чи іншою мірою беруть участь у всіх хімічних процесах, що відбуваються в організмі, з’ясування їхньої структури й перетворень має бути найважливішим для біологічної хімії». Водночас він вивчав хімію вуглеводів, дослідив будову молекул глюкози. Уперше синтезував глюкозу й фруктозу. У 1902 році став лауреатом Нобелівської премії з хімії саме за дослідження хімії вуглеводів. Проте у своїй Нобелівській лекції Фішер сказав: «Поступово завіса, якою природа приховувала свої секрети, була привідхилена в питаннях, що стосуються вуглеводів. Попри це, хімічна загадка Життя не може бути розкрита доти, поки органічна хімія не вивчить інший, складніший предмет — білки». Помер 1919 року в Берліні.
Амінокислоти — замінні та незамінні компоненти організмів
Білки синтезуються з амінокислот, однак не всі амінокислоти, що потрібні для побудови білків, синтезуються в людському організмі. Такі амінокислоти мають назву незамінні1. Вони мусять надходити до організму людини з їжею. Відомо вісім незамінних для людини амінокислот. Вони входять до складу тваринних і рослинних білків у різних співвідношеннях, тому в правильному раціоні повинні бути різноманітні білкові продукти (м’ясо, бобові, яйця, молочні продукти, риба).
Поміркуймо
Знайдіть одну правильну відповідь
1. Якщо кружечками позначено залишки амінокислот, то що може бути фрагментом білка?

2. Які з двох фрагментів білків відрізняються тільки складом?

3. Який із білків складається з кількох амінокислотних ланцюжків?
- А міоглобін
- Б гемоглобін
- В пепсин
- Г каталаза
- Д альбумін
1 На відміну від замінних, які організм здатен синтезувати сам з інших молекул.
4. Назва одного з білків походить від грецького слова kolla (клей), до якого додано суфікс -gen (той, що народжує). Цей білок утворює основу міжклітинної речовини сполучної тканини. На нього багаті хрящі, сухожилля, кістки. Про який білок ідеться?
- А кератин
- Б альбумін
- В гемоглобін
- Г колаген
- Д міозин
5. Якщо на свіжу ранку крапнути розчин гідроген пероксиду, можна спостерігати активне спінювання, спричинене розкладанням пероксиду. Із діяльністю якого білка пов’язане це явище?
- А пепсину
- Б трипсину
- В каталази
- Г міозину
- Д родопсину
Сформулюйте відповідь кількома реченнями
6. Чому білки називають найважливішим складником клітин будь-якого живого організму?
7. Схарактеризуйте біологічне значення білків. Що дає змогу білкам виконувати безліч найрізноманітніших функцій у живих організмах?
8. Білки практично ніколи не відкладаються про запас. Та все ж таки є запасні білки. Наведіть приклади запасних білків і вкажіть, у яких випадках запасним матеріалом є білки.
9. Наведіть кілька причин величезного різноманіття білків. Відповідь підтвердите прикладами.
10. Як пов’язана роль конкретного білка з його тривимірною структурою? Чи можна за тривимірною структурою білка визначити його функцію в організмі? Наскільки точним може бути таке визначення?
Знайди відповідь і наблизься до розуміння природи
11. Є хвороби людини, що пов’язані з порушенням структури тих чи інших білків. Наприклад, серпуватоклітинна анемія розвивається через заміну однієї амінокислоти на іншу в молекулі гемоглобіну. Багато хвороб спричинені зовсім незначними порушеннями в структурі ферментів (фенілкетонурія, таласемія, різні форми порфирій). Поясни, як такі незначні зміни в структурі білків призводять до суттєвих наслідків для організму.
Дізнайся самостійно та розкажи іншим
12. Під час білкового голодування в дитячому віці розвивається квашіоркор — тяжка дистрофія, що супроводжується набряклістю. Набряклість також розвивається й у дорослих під час тривалого білкового голодування. Припусти механізм цього явища.
13. Чому білки — найполіфункціональніші молекули з усіх, що входять до складу нашого організму?
14. Сучасна наука про білковий набір клітини — протеоміка. Чому виникла ця наука та які її завдання?
Доповнення І

Артем Коміссаров
Закінчив Харківську гімназію № 47 у 2009 році. Того ж року виборов бронзову медаль на Міжнародній біологічній олімпіаді в Японії. Закінчив університет у Гейдельберзі.
Зараз навчається в аспірантурі в Центрі геномної регуляції в Барселоні.
Малі органічні молекули. Мономери й полімери
Як ви вже знаєте, усе живе, зокрема й людина, складається з чотирьох основних класів органічних молекул: білків, жирів, вуглеводів і нуклеїнових кислот. Кожен із цих класів представлений тисячами й десятками тисяч молекул, іноді неймовірного рівня складності, але всі вони побудовані лише з декількох десятків типів базових, простих компонентів. Як таке можливо? Насправді еволюція пішла шляхом LEGO: маючи набір із деталей п’яти-шести типів і фантазії, можна побудувати потенційно нескінченну кількість конструкцій, що виконуватимуть будь-яку уявну функцію (рис. І.1). Органічна хімія працює так само! Елементарні молекули називають мономерами (від грец. monos — один і meros — частина). Вони утворюють більш складні молекули, що називають олігомерами (oligos — декілька) та полімерами (polys — багато). Розглянемо зараз цей принцип на прикладі.
Білки, або протеїни

Рис. І.1.
Біоорганічна хімія працює за принципом LEGO: з невеликої кількості простих елементарних частинок можна побудувати безліч різноманітних складних структур із будь-якими функціями.
Наші клітини здатні синтезувати десятки тисяч видів білкових молекул, що виконують найрізноманітніші функції в клітині, і все це розмаїття побудовано лише з 21 типу мономерів — амінокислот. Усі амінокислоти мають одну спільну властивість — можливість утворення лінійних білкових полімерів. Водночас кожна амінокислота має свої унікальні властивості, як, наприклад, розмір, просторова структура, наявність позитивного чи негативного заряду, розчинність у воді, деякі специфічні хімічні властивості. Важливо пам’ятати, що молекулярний світ теж є тривимірнім, тож, щоб краще зрозуміти, що таке протеїни, ми маємо мислити у тривимірному просторі.
Уявіть собі послідовне згортання японського оригамі зі стрічки паперу. Так і ланцюжок із певної послідовності амінокислот визначає дуже специфічне згортання білкового полімеру в 3D-просторі (рис. І.2).

Рис. І.2.
Модель людського цитохрому С, надрукована на 3D-принтері. Ця модель є відображенням реальної структури білка, отриманої за допомогою сучасної кристалографії. Амінокислотний ланцюжок з’єднаний з іншою молекулою — гемом (на моделі сірий). Цитохром С бере участь у процесі дихання.
Коментарі (0)