Йонний і металічний хімічні зв'язки в речовинах
- 15-11-2023, 22:00
- 354
11 клас , Хімія 11 клас Ярошенко (рівень стандарту)
§ 5. Йонний і металічний хімічні зв'язки в речовинах
Інформаційна довідка
• Хімічний зв'язок — це зв'язок між частинками речовини, що забезпечує їй чітко визначену структуру.
• Під час утворення хімічних зв'язків відбувається перерозподіл електронної густини між зв'язаними атомами, встановлюється певна відстань між ними.
• Перерозподіл електронної густини між атомами пов'язаний з електронегативністю — здатністю атома притягувати до себе спільну електронну пару.
• Зв'язки між атомами з різною електронегативністю полярні. Електрони хімічного зв'язку більше часу перебувають біля атома з більшою електронегативністю.
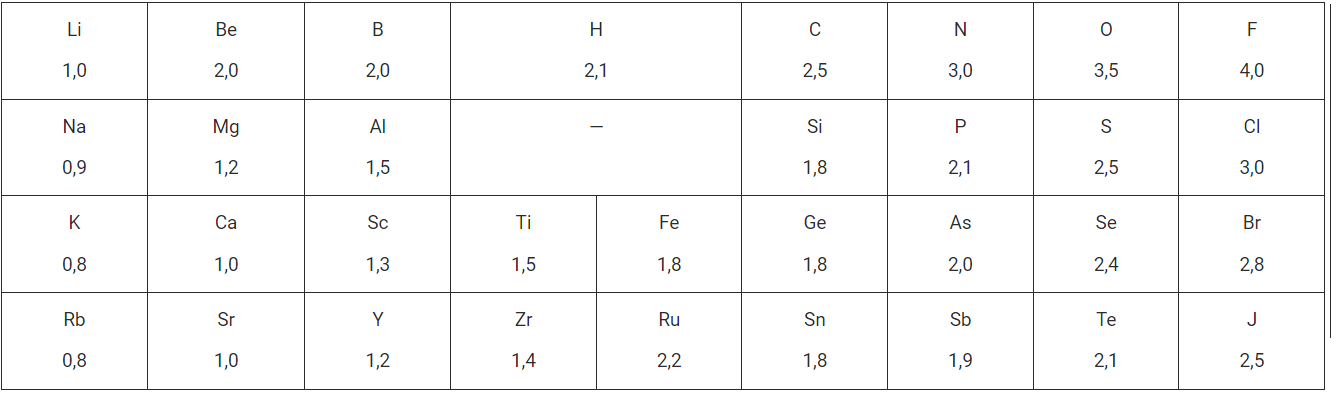
• Емпіричним (отриманим експериментально) критерієм для характеристики електронегативності служать шкали електронегативностей елементів.
• Шкала відносної електронегативності елементів за Полінгом:
• За способом утворення хімічні зв'язки поділяють на: йонний, ковалентний, металічний, водневий.
ПРИРОДА ХІМІЧНОГО ЗВ'ЯЗКУ. Як вам відомо, речовин значно більше, ніж хімічних елементів. Це тому, що атоми хімічних елементів здатні сполучатися між собою, а також з атомами інших елементів у різній кількості та послідовності, утворюючи хімічні зв'язки. У 8 та 10 класах ви знайомилися з йонним, ковалентним і водневим видами хімічного зв'язку. Настав час систематизувати набуті знання й відновити ті, що збереглися в довготривалій пам'яті.
Хімічний зв'язок є результатом взаємодії атомів, унаслідок якої утворюється стійка багатоатомна система (молекула, йон, кристал) і досягається мінімум її потенціальної енергії. Утворення хімічного зв'язку супроводжується пониженням енергії в системі.
Унаслідок утворення хімічних зв'язків енергетичні рівні електронних оболонок атомів стають завершеними. Як ви вже знаєте, завершений зовнішній енергетичний рівень — це рівень із восьми електронів (для Гідрогену, Гелію — із двох).
Внаслідок утворення хімічного зв'язку електронні оболонки атомів набувають стійкої будови. Їхній зовнішній енергетичний рівень стає завершеним і має електронну конфігурацію однакову з найближчим інертним хімічним елементом.
Завершеність електронної конфігурації досягається кількома способами:
- повною передачею валентних електронів іншим атомам;
- повним прийняттям валентних електронів від інших атомів;
- утворенням спільних електронних пар, що одночасно належать обом атомам.
Тобто для того, щоб мати завершений зовнішній енергетичний рівень, атоми можуть приєднувати чи віддавати електрони, або ж утворювати спільні електронні пари. У кожному конкретному випадку спосіб залежить від електронегативності й будови зовнішнього енергетичного рівня електронної оболонки атома.
Значний внесок у розроблення теорії хімічного зв'язку зробив Лайнус Полінг.
Інформаційна сторінка
Лайнус Полінг (1901-1994). Американський хімік, відомий своїми науковими досягненнями в галузі квантової хімії і біохімії. За дослідження природи хімічного зв'язку і її застосування для визначення структури сполук учений був удостоєний у 1954 р. вищої наукової нагороди — Нобелівської премії з хімії. Укладена вченим у 1925 р. шкала електронегативності не втратила наукової значущості й дотепер.

ПОНЯТТЯ ПРО ЙОННИЙ ХІМІЧНИЙ ЗВ'ЯЗОК. На підставі теорії хімічного зв'язку віддавати валентні електрони енергетично вигідно тим атомам, які мають їх небагато (менше половини від тих, що перебувають на зовнішньому енергетичному рівні інертного хімічного елемента). Такими є атоми металічних елементів. Під час утворення хімічних зв'язків з атомами неметалічних елементів вони віддають електрони і перетворюються на позитивно заряджені йони — катіони. Наприклад, Магній утворює бінарну сполуку із Сульфуром MgS — магній сульфід. Розглянути утворення хімічного зв'язку в цій сполуці допоможе інформація малюнка 6 на с. 28.
В атома Магнію на зовнішньому енергетичному рівні лише два електрони. В атома Сульфуру валентних електронів шість, тож йому енергетично вигідніше для завершення зовнішнього енергетичного рівня приєднати два електрони, аніж віддавати шість.
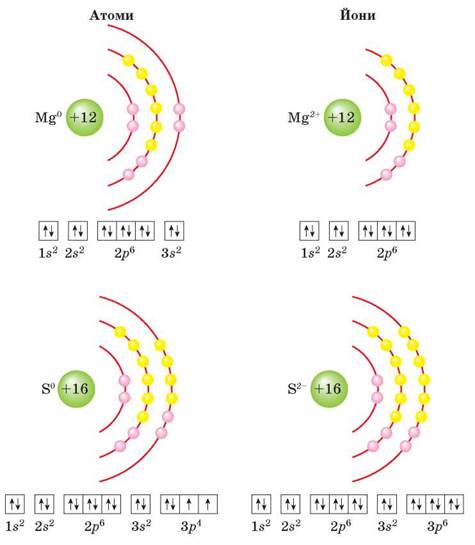
Мал. 6. Схеми будови електронних оболонок атомів і йонів Магнію і Сульфуру
Схема (мал. 7) ілюструє утворення йонного хімічного зв'язку між катіоном Магнію Mg2+ й сульфід-аніоном S2-. Взаємне притягання цих йонів забезпечує цілісність кристалу речовини магній сульфід. Серед речовин з йонним хімічним зв'язком немає рідин і газів.
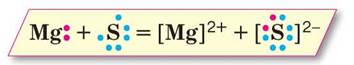
Мал. 7. Схема утворення йонного хімічного зв'язку в магній сульфіді
Йонний зв’язок — це хімічний зв'язок між протилежно зарядженими йонами за рахунок сил електростатичного притягання. Під час його утворення відбувається одностороння передача електронів від одного атома іншому.
Йонний зв'язок можливий між атомами хімічних елементів, що істотно відрізняються між собою величиною електронегативності. Зверніться до шкали електронегативності, що в інформаційній довідці. Знайдіть числові значення електронегативності Літію й Флуору. Висновок однозначний, Літій — елемент з низькою, а Флуор — з найбільшою електронегативністю. Отже, утворена ними складна речовина має йонний зв'язок.
Попрацюйте групами
Завдання 1. Складіть електронну та графічну електронну формули атомів Літію і Флуору.
Завдання 2. Складіть рівняння реакції літію з фтором, розгляньте механізм утворення хімічного зв'язку в продукті реакції.
Завдання 3. Складіть електронну та графічну електронну формули йонів Літію і Флуору.
Чи вдалося атомам хімічних елементів досягти завершеності зовнішнього енергетичного рівня?
Йонний зв'язок утворюється елементами з великою різницею в електронегативності. Електрони завжди переходять від атома з меншою електронегативністю до атома, у якого вона більша.
Йонний хімічний зв'язок існує в бінарних сполуках, утворених з атомів металічних і неметалічних елементів, наприклад Натрію і Хлору (NaCl), Калію і Сульфуру (K2S), Магнію й Оксигену (MgO), а також між катіонами металічних елементів і гідроксид-аніонами в основах й амфотерних гідроксидах, між катіонами металічних елементів й аніонами кислотних залишків у солях.
МЕТАЛІЧНИЙ ЗВ'ЯЗОК. Утворення металічного зв'язку також пов'язане з дією сил електростатичного притягання, що діють між йонізованими атомами металу й делокалізованими валентними електронами, що дістали назву «електронний газ». Справа в тому, що в більшості металів на зовнішньому енергетичному рівні атомів мало валентних електронів (1-2, рідше 3), і вони слабко притягуються до ядра, тому на певний час втрачають зв'язок з ним. Віддавши електрони, такі атоми перетворюються на катіони. Електрони, що втратили зв'язок зі своїми атомами, вільно переміщуються у кристалі металу. Такі електрони стають спільними, бо не належать якомусь конкретному атому (мал. 8 на с. 30). У темі 4 ми повернемося до цього, і ви зрозумієте, яке відношення ці електрони мають до загальних властивостей металів.
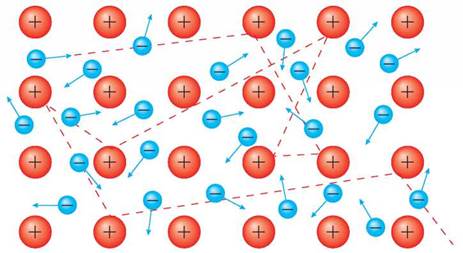
Мал. 8. Схема утворення металічного зв'язку
Металічний зв'язок — це хімічний зв'язок, зумовлений наявністю у металів спільних електронів (ними стають електрони зовнішніх енергетичних рівнів, що втратили зв'язок з ядрами своїх атомів) й катіонів (утворилися внаслідок утрати атомами валентних електронів).
Металічний зв'язок міцний. Як і сполуки з йонним типом зв'язку, метали тверді (виняток становить ртуть), кристалічні, здебільшого тугоплавкі речовини.
Металічний зв'язок у чистому вигляді реалізується тільки у лужних і лужноземельних металах, тоді як інші метали поряд із металічним утворюють ковалентний зв'язок. У металічних р-елементів й особливо у d-елементів тільки невелика частина електронів стають спільними. Наприклад, у металу ніобію на один атом в середньому припадає 1,2 спільних делокалізованих електрони. Інші валентні електрони утворюють ковалентні зв'язки із сусідніми атомами Ніобію. Цим пояснюються висока температура плавлення та велика механічна міцність металів, утворених d-елементами.
Сторінка ерудита
На підставі теорії хімічного зв'язку стає зрозумілою хімічна інертність простих газоподібних речовин гелію, неону, аргону, ксенону, радону. Інертні вони тому, що зовнішні енергетичні рівні електронних оболонок їхніх атомів завершені:
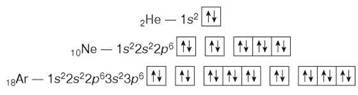
У розглянутій електронній будові спрацьовує правило октету (від лат. okto — «вісім»): електронна оболонка, що містить вісім електронів, є енергетично стійкою. Атом з такою оболонкою неактивний у хімічних реакціях.
Ученим до 1962 р. не вдавалося добути жодної сполуки інертних елементів, хоча Лайнус Полінг у 1933 р. передбачив, що Ксенон, Криптон і Радон можуть утворювати хімічні зв'язки з найбільш електронегативними атомами Оксигену чи Флуору. Нині у спеціальних умовах синтезовано понад 200 сполук Ксенону, Криптону й Радону з Оксигеном та Флуором.
Знаємо, розуміємо
- 1. Дайте визначення катіонів й аніонів, наведіть приклади.
- 2. Поясніть, як відбувається утворення йонного та металічного зв'язків.
- 3. Яких змін зазнає електронна оболонка атомів металічних елементів під час утворення йонного хімічного зв'язку? Поясніть на конкретному прикладі.
- 4. Яких змін зазнає електронна оболонка атомів неметалічних елементів під час утворення йонного хімічного зв'язку? Поясніть на конкретному прикладі.
- 5. Укажіть, які з речовин утворені металічним, а які — йонним хімічним зв'язком: літій оксид, залізо, калій сульфід, алюміній.
Застосовуємо
- 1. Чи може утворитися йонний зв'язок між атомами Хлору і Сульфуру? Відповідь аргументуйте.
- 2. Складіть електронні формули атомів Калію і Хлору. Поясніть, яким чином між атомами цих елементів утворюється йонний зв'язок у калій хлориді.
- 3. Атом елемента має на два електрони більше, ніж катіон Калію. Назвіть елемент, складіть електронну формулу його атома. Чи можуть атоми цього елемента утворювати йонний зв'язок?
- 4. Атом елемента має на сім електронів менше, ніж сульфід-аніон. Назвіть елемент, складіть електронну формулу його атома. Яким способом він зможе досягти завершеності електронної конфігурації атома під час утворення хімічного зв'язку?
Коментарі (0)