Кислоти, властивості і добування. Кислотні дощі
- 15-11-2023, 22:16
- 297
11 клас , Хімія 11 клас Ярошенко (рівень стандарту)
§ 20. Кислоти, властивості і добування. Кислотні дощі
Інформаційна довідка
• Кислоти — це електроліти, які у водному розчині дисоціюють на катіони Гідрогену й аніони кислотного залишку:
![]()
• Загальна формула речовин цього класу:

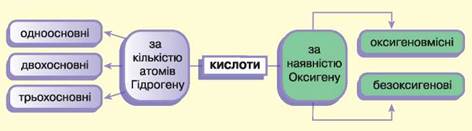
• Існує кілька класифікацій кислот:
• Водневий показник (рН) використовують для характеристики середовища розчинів.
• Шкала значень рН розчинів: в інтервалі від 0 до 7 — кислотне середовище; 7 — нейтральне; від 8 до 14 — лужне.
• Що меншим є значення рН, то вищою буде кислотність.
• Крім неорганічних, існують органічні (карбонові кислоти). Пригадайте з 10 класу, що ви знаєте про них, наведіть приклади.
ХІМІЧНІ ВЛАСТИВОСТІ КИСЛОТ. Катіони Гідрогену зумовлюють загальні хімічні властивості кислот, кислотні залишки — специфічні.
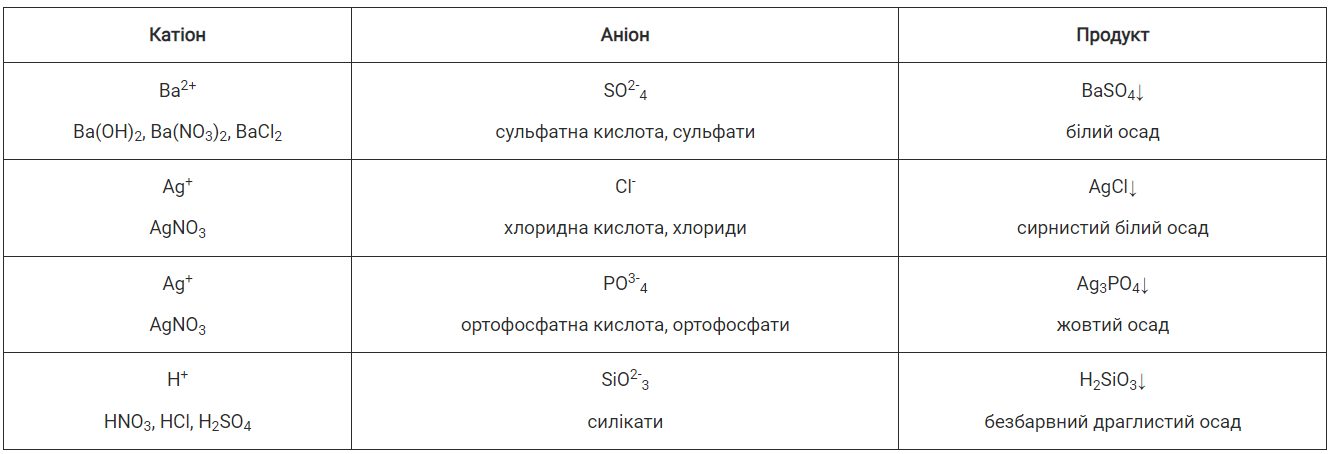
Про специфічні властивості деяких кислот ви дізналися в попередніх класах. Так специфічною властивістю сульфатної кислоти, а точніше сульфат-аніона, є утворення нерозчинної солі барій сульфату (білого осаду) з катіонами Барію Ва2+. Оскільки зазначені аніони входять до складу сульфатів, то всі розчинні сульфати аналогічно кислоті взаємодіють з електролітами, що містять катіони Барію Ва2+. Специфічна властивість хлоридної кислоти полягає в утворенні білого сирнистого нерозчинного осаду аргентум(І) хлориду з катіонами Аргентуму Ag+. Усі розчинні хлориди взаємодіють з розчином, що містить катіони Аргентуму Ag+.
Попрацюйте групами
Завдання 1. Актуалізуйте знання про властивості кислот, скориставшись матеріалом схеми (мал. 43).
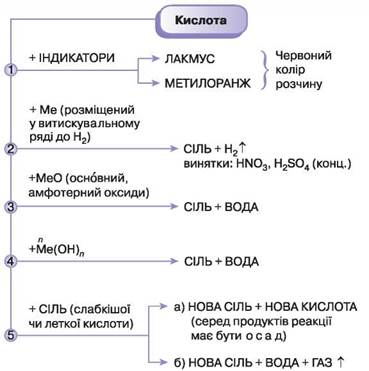
Мал. 43. Схема хімічних властивостей кислот
Завдання 2. Проілюструйте схему прикладами рівнянь реакцій.
Особлива властивість ортофосфатної кислоти й ортофосфатів полягає в утворенні під час реакцій йонного обміну жовтого осаду аргентум(І) ортофосфату Ag3PO4, що не розчиняється у воді, але розчинний у концентрованій нітратній кислоті:
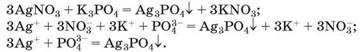
Силікатна кислота нерозчинна у воді. Розчинними є силікати лужних елементів та амонію. У них силікат-аніони SiO2-3 можна виявити за допомогою сильної кислоти (нітратної, хлоридної, сульфатної):
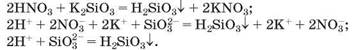
Узагальнимо відомості про хімічні властивості вивчених неорганічних кислот, щоб було зручно користуватись інформацією під час проведення якісних реакцій й визначення йонів у розчинах (табл. 9 на с. 106).
Таблиця 9
ПОНЯТТЯ ПРО КИСЛОТНІ ДОЩІ ТА ПРИЧИНИ ЇХ ВИНИКНЕННЯ. Чи доводилося вам спостерігати, як після довгоочікуваного літнього дощу рослини, замість того, щоб рости й плодоносити, жовкнуть, в'януть і навіть гинуть (досить часто це трапляється з огірками)? З великою ймовірністю можна стверджувати, що дощ був не звичайний, а кислотний, саме він і завдав шкоди рослинам. Кислотні дощі пошкоджують листки, руйнують їхні захисні воскові покриви, через що ті стають легкопроникними для комах, шкідливих грибів і мікроорганізмів. Змінюється обмін речовин у клітинах рослин, що сповільнює їх ріст і розвиток, знижуються врожаї. Під дією кислотних опадів істотно прискорюється корозія металів, порушується цілісність лакофарбових покриттів і скла, руйнуються будівлі й пам'ятники архітектури. Окрім рослин, кислотні дощі завдають шкоди тваринам, водоймам і водоростям, збільшують кислотність ґрунтів, погіршуючи їх родючість. Унаслідок контактування з кислотними дощами у людей підвищується ризик захворювання на астму, алергію, онкологічні захворювання.
Кислотні дощі — це всі види опадів (дощ, сніг, град, туман), кислотність яких нижча за 5,5. Хімічний аналіз кислотних дощів показує наявність у них сульфітної, сульфатної, нітритної, нітратної кислот. Поява цих речовин в опадах — наслідок забруднення атмосфери оксидами Сульфуру та Нітрогену.
Оксиди Сульфуру й Нітрогену потрапляють в атмосферу під час переробки нафти, спалювання викопного палива (теплові електростанції) і вуглеводневого пального у двигунах внутрішнього згорання (автомобільний транспорт, літаки), а також разом з викидними газами металургійних і хімічних підприємств. Усе це — джерела кислотних дощів антропогенного походження.
Природними джерелами надходження сульфур(IV) оксиду в атмосферу є виверження вулканів. Природні надходження в атмосферу оксидів Нітрогену відбуваються під час електричних розрядів (блискавок) за схемою:
азот повітря → нітроген(II) оксид → нітроген(IV) оксид.
• Складіть рівняння за даною схемою.
ҐРУНТИ Й КИСЛОТНІ ДОЩІ. Ґрунти теж потерпають від кислотних дощів: знижується родючість ґрунту, змінюється склад ґрунтових мікроорганізмів, погіршується доступність поживних речовин для рослин.
Кислотність ґрунтів — властивість, зумовлена наявністю в ґрунтовому розчині катіонів Гідрогену Н+. Кислотні ґрунти — це ґрунти, рН яких менше від 7, нейтральні — близько 7, а лужні — понад 7.
Як вам відомо, для визначення точного показника кислотності використовують рН-метри, а також спеціальні електронні прилади. Доступним для вас є спосіб визначення кислотності за допомогою універсального індикаторного папірця. Порівнюючи його колір у досліджуваному середовищі зі шкалою (мал. 44 на с. 108), з'ясовують, кислотним, лужним чи нейтральним воно є.
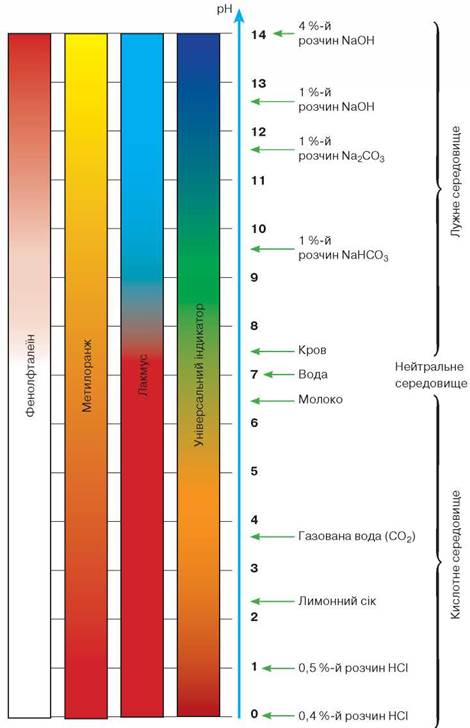
Мал. 44. Забарвлення індикаторів у рідинах з різним значенням pH
Хімія — це життя: сторінка природодослідника
Удома кожен з вас може виготовити індикаторний папір із соку червоноголової капусти чи соку смородини. Зверніться до Інтернету за інформацією, як виготовити такий папір, і випробуйте його на розчинах лимонної кислоти, оцту, мила, прального порошку, а також дощовій чи сніговій воді. Розташуйте випробувані вами розчини за збільшенням водневого показника. Зробіть висновок, як змінюється кислотність ґрунту навколо місця миття машини мийними засобами в домашніх умовах.
ЯК ВИНИКАЮТЬ КИСЛОТНІ ОПАДИ? Кислотний дощ утворюється в атмосфері в результаті реакції між водяною парою й такими забруднювальними речовинами, як сульфур(IV) оксид SO2, сульфур(VI) оксид SO3, нітроген(IV) оксид NO2. Це кислотні оксиди, тому продуктами реакцій з водою є сульфатна, сульфітна, нітратна, нітритна кислоти.
Хімізм розглянутих процесів передають такі рівняння реакцій:
1) Н2О + SO2 = H2SO3 (сульфітна кислота),
2H2SO3+ O2 = 2H2SO4(сульфатна кислота);
2) у результаті фотохімічного окиснення сульфур(ІV) оксид зазнає перетворення за схемою SO2 → SO3:
2SO2+ О2 = 2SO3;
3) Н2О + SO3= H2SO4(сульфатна кислота);
4) несолетворний нітроген(ІІ) оксид у повітрі легко окиснюється до нітроген(IV) оксиду, який є кислотним оксидом двох кислот:
![]()
Утворені кислоти в аерозольному вигляді перебувають у хмарах, а разом з опадами потрапляють на землю (мал. 45). Аерозолі сульфітної й сульфатної кислот складають близько 2/3 кислотних опадів, 1/3 — це аерозолі нітритної й нітратної кислот.
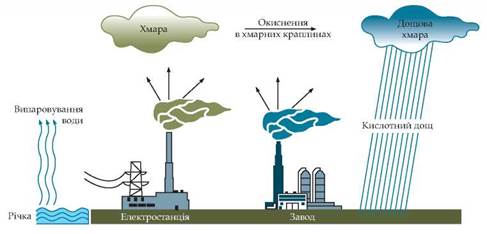
Мал. 45. Схема утворення кислотних дощів
Дощова вода, що утворюється в результаті конденсації водяної пари, повинна мати нейтральну реакцію середовища, тобто рН = 7. Проте до складу повітря входить вуглекислий газ (об'ємний вміст близько 0,03 %) і дощова вода, яка розчиняє його з утворенням карбонатної кислоти, ледь підкислюється. Тому рН дощової води дещо нижче цього показника.
Сторінка ерудита
Останнім часом до розглянутих чинників кислотних дощів додається ще й хлоридна кислота. Вона утворюється з хлору, що потрапляє в атмосферу з викидними газами підприємств або внаслідок аварій: взаємодіє з метаном (він надходить у повітря над рисовими полями, а також у результаті танення гідрату метану у вічній мерзлоті через потепління клімату).
До фізико-хімічних методів очищення газових викидів належать абсорбція й адсорбція. Абсорбція — це процес поглинання газів або парів рідиною з утворенням розчину. Апарати для такого очищення називають абсорберами. У них очищуваний газ і абсорбувальна рідина рухаються назустріч одне одному. Абсорбцію застосовують для очищення повітря і викидних газів, що містять токсичні забруднення — кислотні тумани, ціанідну чи етанову кислоти, сірчистий газ, оксиди Нітрогену, різні розчинники тощо. Як поглинач використовують суспензії, що містять оксиди Магнію і Кальцію або вапняк. Ефективність очищення становить 90-95 %. Шлами після очищення можуть використовуватися для подальшого перероблення. Недоліком цих апаратів є ускладнення процесу видалення шламів у разі утворення важкорозчинних речовин.
Адсорбційний метод очищення газів — це сорбція газоподібних речовин на поверхні або в об'ємі мікропор твердого тіла. Тверду речовину, на поверхні або в об'ємі пор якої відбувається концентрування очищуваних речовин, називають адсорбентом. Поглинені забруднювальні речовини, що перебувають у газовій або рідкій фазі, називають адсорбтивом, а після переходу в адсорбований стан — адсорбатом. Найчастіше як адсорбент використовують активоване вугілля, силікагель та глини, що мають пористу поверхню. Один грам активованого вугілля має поверхню близько 5 км2. Вилучені з очищуваних газів речовини (адсорбтиви), які в подальшому видаляють шляхом десорбції, можуть бути використані для тих або інших цілей. Цей процес називають регенерацією адсорбенту і здійснюють здебільшого нагріванням перегрітою парою.
ШЛЯХИ ВИРІШЕННЯ ПРОБЛЕМИ КИСЛОТНИХ ДОЩІВ. Щоб запобігти кислотним дощам, необхідно скорочувати викиди кислотоутворювальних речовин в атмосферу: установлювати пиловловлювачі й фільтри для очищення газоподібних викидів, викликаних антропогенними чинниками; користуватись високоякісним пальним для автомобілів, застосовувати альтернативні джерела енергії, упроваджувати безвідходні технології, застосовувати фізико-хімічні і хімічні методи очищення викидів в атмосферу, і в перспективі — створення екологічно безпечних виробництв.
Якщо концентрація оксидів-забруднювачів у повітрі збільшується, то кислотні дощі створюють реальну загрозу людині, рослинному й тваринному світу.
Дощова вода, що утворюється в результаті конденсації водяної пари, мала б нейтральне середовище. Проте і в дуже чистому повітрі завжди є вуглекислий газ, і водневий показник дощової води, у якій він розчиняється, дорівнює 5,6-5,7.
Очищення промислових викидів не тільки захищає атмосферу від забруднень, а й дає додаткову сировину підприємствам. Наприклад, уловлювання сірки з газових відходів металургійних комбінатів забезпечує санітарне очищення та здешевлює отримання додаткової кількості сульфатної кислоти.
У перспективі — створення екологічно безпечних виробництв, у цілому всі нові технології повинні впроваджуватися тільки після оцінки їх впливу на навколишнє середовище.
Поступовий перехід на екологічні електромобілі, більш широке використання електротранспорту (тролейбусів, трамваїв, метрополітену), також буде кроком на шляху до подолання проблеми виникнення кислотних дощів.
Проблема убезпечення Землі від кислотних дощів є інтернаціональною. Адже повітряні течії розносять кислотні хмари й тумани на тисячі кілометрів від місць їх виникнення. Тому всі люди повинні дбати про чистоту повітря.
Знаємо, розуміємо
- 1. Наведіть приклади класифікацій кислот з неорганічної й органічної хімії.
- 2. Поясніть суть кислотних дощів.
- 3. Назвіть антропогенні й природні причини появи в атмосфері оксидів неметалічних елементів.
- 4. Чим небезпечні кислотні дощі?
Застосовуємо
- 1. Із переліку наведених формул виберіть і класифікуйте формули кислот: NH3, НСl, H2SO4, Na2SO3, Cu(OH)2, Н3РО4, H2S, HNO3, NO2.
- 2. Є речовини: літій оксид, нітратна кислота, купрум(ІІ) гідроксид, ферум(ІІ) оксид, кальцій гідроксид, сульфатна кислота, барій хлорид, цинк сульфат, карбон(IV) оксид. Які з цих речовин взаємодіятимуть із хлоридною кислотою? Складіть рівняння можливих реакцій.
- 3. Підготуйте розповідь про способи вирішення проблеми кислотних дощів.
Працюємо з медійними джерелами
Створіть лепбук на тему «Джерела утворення кислотних дощів»
Коментарі (0)