Будова електронних оболонок атомів хімічних елементів. Електронні та графічні електронні формули атомів s-, p-, d-елементів
- 16-11-2023, 13:52
- 463
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 2. БУДОВА ЕЛЕКТРОННИХ ОБОЛОНОК АТОМІВ ХІМІЧНИХ ЕЛЕМЕНТІВ. ЕЛЕКТРОННІ ТА ГРАФІЧНІ ЕЛЕКТРОННІ ФОРМУЛИ АТОМІВ s-, p-, d-ЕЛЕМЕНТІВ
Опанувавши матеріал параграфа, ви зможете:
- знати поняття «електронна формула», або «електронна конфігурація», «графічні електронні формули»;
- називати s-, p-, d-елементи за їхнім розміщенням у періодичній системі;
- складати електронні та графічні електронні формули атомів s-, p-, d-елементів; електронні та графічні електронні формули атомів неметалічних елементів 2 і 3 періодів в основному та збудженому станах;
- аналізувати відмінності електронних конфігурацій атомів s-, p-, d-елементів (Ферум) 1-4 періодів;
- характеризувати принцип «мінімальної енергії»; основний та збуджений стани атомів; розміщення s-, p-, d-елементів у періодичній системі.
Пригадайте, що таке електронні та графічні електронні формули.
Електронні та графічні електронні формули. У § 1 ви ознайомилися з розподілом електронів на енергетичних рівнях і підрівнях (табл. 1, с. 9). Його відображають електронними та графічними електронними формулами. Згідно з принципом «мінімальної енергії», електрон займає вільну орбіталь з найменшою енергією, тобто цей електрон найміцніше притягується ядром атома.
В електронних формулах, які ще називають електронними конфігураціями, цифрами вказують номер енергетичного рівня та кількість електронів на орбіталях, а латинською літерою позначають енергетичний підрівень. Тож електронна формула атома Гідрогену, що має заряд ядра атома +1, або в запису 1Н, записується 1s1. Розглянемо рис. 5 і з’ясуємо, що означає такий запис.
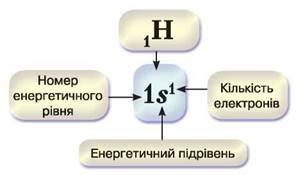
Рис. 5. Електронна формула атома Гідрогену
Крім електронних формул, структуру електронних оболонок атомів відображають графічними електронними формулами. Орбіталь графічно позначають квадратом, який називають енергетичною коміркою, електрони — стрілкою, що вказує на орієнтацію спіну електрона. Якщо квадрат без стрілки, то це означає, що орбіталь вільна. Її може зайняти електрон, коли атом перебуває в збудженому стані.
У квадраті може бути одна або дві стрілки: одна стрілка символізує один неспарений електрон, дві протилежно напрямлені стрілки — два електрони з антипаралельними спінами, тобто спарені електрони.
Приклади запису графічних електронних формул атомів хімічних елементів 1 періоду зображено на рис. 6 (с. 12).
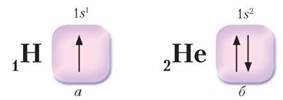
Рис. 6. Графічні електронні формули атомів Гідрогену (а) і Гелію (б)
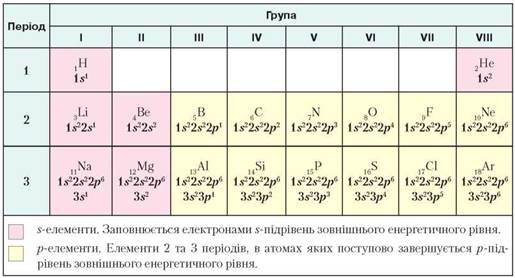
Пригадаємо, як записують електронні формули атомів елементів 1-3 періодів і розміщення цих елементів у періодичній системі (табл. 2).
Таблиця 2
Електронні формули атомів елементів 1-3 періодів та їхнє розміщення в періодичній системі
Розглянемо докладніше графічні електронні формули. Оскільки з формулами атомів Гідрогену та Гелію ви ознайомилися на рис. 6, то звернемо увагу на елементи з порядковими номерами 3-18 (рис. 7).
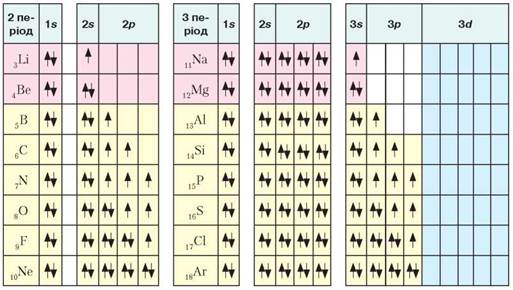
Рис. 7. Розміщення електронів по орбіталях в атомах елементів 2 та 3 періодів в основному стані
Проаналізуємо розміщення електронів в атомах елементів 2 періоду. Як бачимо, в атомах елемента Літію 3Lі формується новий (другий) енергетичний рівень. Його утворює s-електрон, сферична орбіталь якого така сама, як і в атомах Гідрогену, але з більшим запасом енергії. Тому електронна хмара, яку він описує під час руху навколо ядра, більша за розміром. В атомах елемента Берилію 4Ве четвертий електрон розміщується на s-орбіталі другого енергетичного рівня; s-підрівень стає завершеним, електрони спарені. Починаючи з Бору 5В, в атомах елементів заповнюється р-орбіталь. Крім двох s-електронів, п’ятий — це неспарений р-електрон, який під час руху навколо ядра атома описує електронну хмару у формі гантелі. В атомах Карбону 6С й Нітрогену 7N неспарені р-електрони заповнюють вільні р-орбіталі цього енергетичного рівня, а від Оксигену 8О до Неону 10Ne відбувається спарювання p-електронів з антипаралельними спінами. Другий енергетичний рівень в атомах Неону завершений.
В атомах елементів 3 періоду заповнення електронами зовнішнього енергетичного рівня повторює послідовність другого рівня. Як бачимо з рис. 7, 3d-підрівень залишається вільним.
Електронна та графічна електронна формули атома Феруму. Розглянемо електронну та графічну електронну формули атома Феруму. Це елемент 4 періоду, головної підгрупи VIII групи періодичної системи хімічних елементів.
В атомах елементів, що входять до 4 періоду, починаючи зі Скандію (21), заповнюється d-підрівень. Електронна оболонка елемента Феруму складається з 26 електронів, що розташовані на чотирьох енергетичних рівнях. Їхнє розміщення відображає електронна формула 1s22s22p63s23p63d64s2, або [Ar] 3d64s2.
Розглянемо графічну електронну формулу атома Феруму (рис. 8).
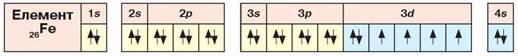
Рис. 8. Розміщення електронів по орбіталях атома Феруму
З електронної та графічної електронної формул бачимо, що в утворенні хімічних зв’язків можуть брати участь не тільки 4s, а й 3d-електрони. У сполуках Ферум найчастіше утворює йони Fe2+ і Fe3+, утрачаючи два або три електрони. Тільки за особливих умов можуть використовуватися всі шість електронів з утворенням фератів. Елементи, у яких заповнюються внутрішні d-підрівні, називають d-елементами. Ферум d-елемент.
Отже, можна зробити висновок:
• хімічні елементи, в атомах яких заповнюється електронами s-підрівень зовнішнього енергетичного рівня, називають s-елементами·,
• хімічні елементи, в атомах яких заповнюється електронами р-підрівень зовнішнього енергетичного рівня, називають р-елементами;
• хімічні елементи, в атомах яких заповнюється електронами d-підрівень другого ззовні енергетичного рівня, а на зовнішньому залишається один або два електрони, називають d-елементами.
Розміщення s-, p-, d-елементів у періодичній системі. У табл. 2 (с. 12) s-, p-елементи виділені кольорами: s-елементи — рожевим, p- — жовтим.
Вам відомо, що внаслідок розташування періодів один під одним утворюються групи, які поділяють на підгрупи А і В. У головних підгрупах (підгрупи А) І та II груп розміщуються s-елементи. До них також належать два елементи 1 періоду, тобто Гідроген і Гелій.
У головних підгрупах III—VIII груп розміщуються р-елементи. У їхніх атомах заповнюється електронами р-підрівень зовнішнього енергетичного рівня.
У побічних підгрупах I—VIII груп розміщуються d-елементи. У їхніх атомах заповнюється електронами d-підрівень попереднього енергетичного рівня.
Отже, за розміщенням хімічних елементів у періодичній системі можна скласти електронну та графічні електронні формули будь-якого з елементів, і навпаки, за електронною або графічною електронною формулою атома елемента — з’ясувати розміщення елемента в періодичній системі.
Збуджений стан атома. Вам уже відомо, що атоми елементів можуть перебувати в основному та збудженому станах. Основний стан атома характеризується найменшою енергією під час руху електронів навколо ядра, електрон в основному стані зв’язаний з ядром атома найміцніше. Усі електронні формули атомів елементів, наведених у табл. 2, — формули атомів в основному стані.
Під час хімічних перетворень атоми, поглинаючи додаткову енергію (теплову, радіаційну), можуть переходити в збуджений стан, віддаючи або приєднуючи електрони. Це стан атома з вищим рівнем енергії, унаслідок чого зв’язок з ядром послаблюється аж до відриву електрона. Розглянемо електронні та графічні електронні формули атомів неметалічних елементів 2 і 3 періодів (рис. 9).
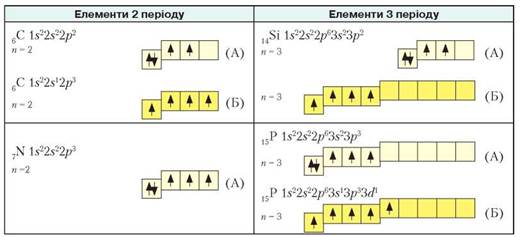
Продовження рис. 9
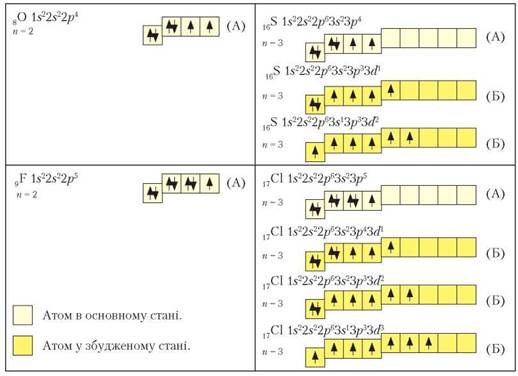
Рис. 9. Розміщення електронів по орбіталях в атомах неметалічних елементів 2 та 3 періодів в основному (А) та збудженому (Б) станах
Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2 та 3 періодів. Уявлення про основні та збуджені стани атомів елементів дають змогу пояснити поняття «валентність» і періодичність її зміни. Насамперед будова електронної оболонки й енергетичних рівнів впливає на зміну радіуса атома. У межах одного періоду атомний радіус зменшується, бо із зростанням заряду ядра атома збільшуються сили притягання. З переходом до наступного періоду (див. табл. 2, с. 12) збільшується кількість енергетичних рівнів, а тому значно зростає радіус атома. Такі зміни спостерігаються в усіх періодах періодичної системи. Кожний новий період починається атомом, у якого формується новий енергетичний рівень (зовнішній) з одним s-електроном, що зумовлює стрибкоподібну зміну властивостей елементів та їхніх простих і складних речовин.
Пригадайте, у чому полягає відмінність між валентністю атомів елементів та їхніми ступенями окиснення.
Максимальну валентність атомів елементів і, відповідно, їхніх ступенів окиснення можна визначити за номером групи, у якій розміщений елемент. У головних підгрупах ці характеристики збігаються з кількістю електронів на зовнішньому енергетичному рівні. Найвищий ступінь окиснення елемент проявляє, коли утворює сполуки з найбільш електронегативними Оксигеном і Флуором. Серед усіх елементів електронегативність Флуору є найбільшою. Тому, утворюючи сполуки, він завжди має ступінь окиснення -1. Оксиген у сполуках з іншими елементами проявляє негативний ступінь окиснення, найчастіше -2, крім сполуки OF2, у якій його ступінь окиснення дорівнює +2. У пероксидах (H2O2, Na2O2), де атоми Оксигену сполучені між собою ковалентним неполярним зв'язком, ступінь окиснення становить -1. Атоми цих елементів не переходять у збуджений стан. Атом Нітрогену, приєднуючи три електрони на зовнішній енергетичний рівень, утворює стійку електронну конфігурацію з восьми електронів. Ступінь окиснення становить -3. Це відбувається під час взаємодії з менш електронегативним елементом.
Однак збудження атомів Нітрогену, Оксигену та Флуору — 2s22p3, 2s22p4 та 2s22p5 відповідно — неможливе, тому що в них немає незаповнених підрівнів.
Про особливості будови атома Карбону та здатність утворювати безліч сполук вам відомо з курсу хімії 9 й 10 класів.
У неметалічних елементів ступені окиснення можуть змінюватися. Це залежить від того, скільки електронів (усі або частина) переміщаються (зміщуються) від одного атома до іншого. Нітроген, взаємодіючи з більш електронегативними елементами, може проявляти ступінь окиснення +1, +2, +3, +4, +5 залежно від того, скільки електронів зміщується.
Атоми неметалічних елементів 3 періоду мають вакантний d-підрівень. У разі надання їм енергії електрони переходять із s- і р-підрівнів на d-підрівень і мають можливість збільшити кількість неспарених електронів. Наприклад, 14Si, 15P. Цим пояснюється чотири- й п'ятивалентність цих елементів відповідно.
Атоми Сульфуру та Хлору здатні мати декілька збуджених станів і, відповідно, проявляти різні ступені окиснення залежно від кількості неспарених електронів на зовнішньому енергетичному рівні. Розглянемо це на прикладі атома Хлору (табл. 3).
Таблиця 3
Стани атома Хлору та їхні характеристики
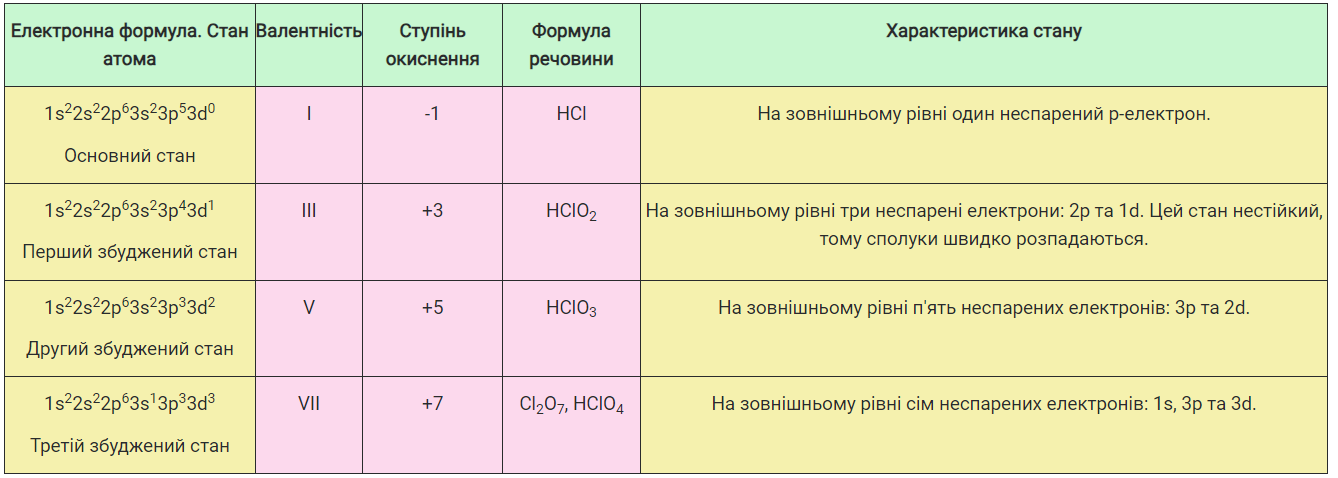
Однак числові значення ступеня окиснення та валентності можуть не збігатися. Наприклад, у молекулах простих речовин, утворених неметалічними елементами, ступінь окиснення дорівнює нулю, а валентність залежить від кількості електронів, які атоми елементів віддають для утворення спільних електронних пар.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Електронні формули, або електронні конфігурації, відображають розподіл електронів в атомі. Вони вказують на розміщення електронів на енергетичних рівнях, де цифрами 1, 2, 3, ..., 7 позначають енергетичний рівень, літерами s-, p-, d-, f- — енергетичні підрівні та форму орбіталей, а цифрою в степені — кількість електронів на підрівні. Наприклад: 9F 1s22s22p5.
• Графічні електронні формули відображають структуру електронних оболонок атомів. Орбіталь позначають квадратом (його називають енергетичною коміркою), а електрони — стрілками. Якщо квадрат вільний — на орбіталі відсутній електрон, якщо є одна стрілка — електрон неспарений, якщо дві стрілки, спрямовані в протилежних напрямках, — спарені електрони з антипаралельними спінами.
• Енергетичні рівні заповнюються поступово: спочатку s-підрівень, за ним р-підрівень, що має три орбіталі, за ним d-підрівень, якому властива наявність п'яти орбіталей. Відповідно максимальна кількість електронів на s-підрівні — 2, на p-підрівні — 6 і на d-підрівні — 10.
• s-елементи розміщуються в головних підгрупах (підгрупи А) І та ІІ груп періодичної системи. До них також належать два елементи 1 періоду, тобто Гідроген і Гелій.
• р-елементи — елементи, в атомах яких заповнюється електронами p-підрівень, розміщуються в головних підгрупах ІІІ—VIII груп.
• d-елементи — елементи, в атомах яких заповнюється d-підрівень попереднього енергетичного рівня, і розміщуються вони в побічних підгрупах І—VIII груп.
• У збудженому стані кількість електронів на зовнішньому енергетичному рівні зростає, тому атоми, перебуваючи в цьому стані, проявляють змінні валентність і ступені окиснення.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Поясніть, що відображає електронна формула атома.
- 2. Напишіть електронні формули атомів елементів 2 періоду та поясніть, які зміни спостерігаються в будові атомів елементів.
- 3. Поясніть, як, крім електронної формули, можна зобразити структуру електронних оболонок атомів.
- 4. Охарактеризуйте на основі електронних і графічних електронних формул розміщення s-, p-, d-елементів у періодичній системі.
- 5. Проаналізуйте відмінності електронних конфігурацій атомів s-, p-, d-елементів (Ферум) 1-4 періодів.
- 6. Поясніть, що означає принцип «мінімальної енергії».
- 7. Охарактеризуйте основний та збуджений стани атома на прикладі атомів Сульфуру та Хлору, поясніть валентні стани та ступені окиснення цих елементів у сполуках.
- 8. Укажіть електронну формулу атома Силіцію в основному стані.
А 1s22s22p63s23p3
Б 1s22s22p63s23p1
В 1s22s22p63s23p4
Г 1s22s22p63s23p2
- 9. Укажіть електронну формулу атома Хлору в другому збудженому стані.
А 1s22s22p63s23p33d2
Б 1s22s22p63s13p33d3
В 1s22s22p63s23p53d0
Г 1s22s22p63s23p5
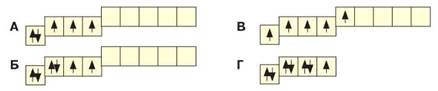
- 10. Укажіть графічну електронну формулу атома Фосфору в збудженому стані.
Коментарі (0)