Види хімічних зв'язків: металічний зв'язок
- 16-11-2023, 13:55
- 336
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 7. ВИДИ ХІМІЧНИХ ЗВ'ЯЗКІВ: МЕТАЛІЧНИЙ ЗВ'ЯЗОК
Опанувавши матеріал параграфа, ви зможете:
- називати речовини з металічним зв'язком;
- пояснювати механізм утворення металічного зв'язку в металах; будову речовин на основі їхніх фізичних властивостей;
- порівнювати механізм утворення металічного зв'язку з механізмами утворення ковалентного та йонного зв'язків;
- прогнозувати фізичні властивості металів на основі їхньої будови.
Металічний зв'язок. Металічні елементи утворюють прості речовини-метали. Ці речовини перебувають здебільшого у твердому стані (крім ртуті). Для будови їхніх атомів характерна невелика кількість електронів на зовнішньому енергетичному рівні (1-3, рідше 4). Так, в атомів елементів головної підгрупи І групи — по одному електрону, головної підгрупи ІІ групи — по два. Через віддаленість зовнішнього енергетичного рівня від ядра атома ці електрони легко відриваються від нього й переміщаються по всьому об'єму кристала. Атоми, утрачаючи електрони, перетворюються на позитивно заряджені йони (катіони). Тому у вузлах кристалічних ґраток металів локалізуються позитивно заряджені йони, які щільно упаковуються один біля одного. Зв'язок між йонами здійснюється завдяки вільному переміщенню електронів, що є спільними для всіх йонів. Сукупність вільних електронів дістала назву електронний газ (рис. 21).
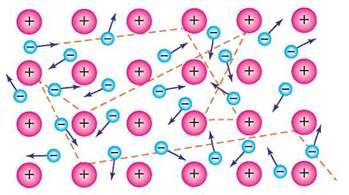
Рис. 21. Катіони металічних елементів і вільні електрони (електронний газ)
З'ясуємо, чому електрони в металах здатні вільно переміщатися. Це залежить від будови атомів металічних елементів. У кристалах металів електронів значно менше, ніж вільних орбіталей. Наприклад, в атома Натрію на зовнішньому енергетичному рівні є чотири орбіталі, але тільки один електрон. Це дає змогу електронам вільно переміщатися від одного атома до іншого.
• Металічний зв'язок — це особливий вид зв'язку, що утворюється внаслідок взаємодії вільних електронів з йонами металічних елементів.
Особливість металічного зв'язку полягає в тому, що, як і в йонних сполуках, у вузлах кристалічних ґраток розміщені йони. Але, на відміну від йонних сполук, де йони різнойменно заряджені, у металів вони заряджені тільки позитивно.
Металічний зв'язок проявляє подібність і до ковалентного. Проте за ковалентного зв'язку участь в утворенні спільних електронних пар бере чітко визначена кількість електронів, якими спільно користуються атоми, що утворили ці пари. У металічних ґратках усі електрони рухливі, вони не утримуються біля окремих атомів (йонів), що й впливає на властивості металів.
Фізичні властивості металічних речовин. Унаслідок постійного руху електронів метали проявляють високу електропровідність. Однак, залежно від типу й розмірів кристалічних ґраток і певної кількості електронного газу, ці властивості неоднакові. Найбільшу електропровідність мають срібло, алюміній та мідь. З цієї ж причини метали теплопровідні.
Електронний газ, який рухається між щільно упакованими йонами, відбиває світлові промені, що спричиняє властивий усім металам металічний блиск.
Металам притаманні міцність і пластичність. Ці властивості зумовлені електронною будовою металів. Під час механічної дії окремі шари йонів металічних ґраток зміщуються, а слідом за ними переміщається електронний газ. Тому метали зберігають міцність, пластичність і ковкість. Схематичне зображення та моделі різних типів кристалічних ґраток металів показано на рис. 22 (с. 40).
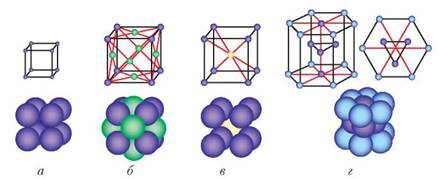
Рис. 22. Моделі кристалічних ґраток металів: а — кубічні; б — кубічні гранецентровані; в — кубічні об'ємноцентровані; г — гексагональні
Будову кристалічних ґраток металів можна переглянути в інтернет-мережі в 3D-проектуванні.
Фізичні властивості й тип кристалічних ґраток речовини взаємопов'язані. Знаючи будову речовин, можна прогнозувати їхні властивості й навпаки.
Знання будови речовини й уміння спрогнозувати її властивості мають практичне значення для людини. Так, довідавшись про небезпеку для здоров'я парів ртуті, учимося безпечно поводитися з приладами, які її містять. Метали використовують у машино- й літакобудуванні, будівництві, для виробництва сплавів тощо. Дбайливе ставлення до природних ресурсів забезпечить стабільний розвиток металургійного виробництва, розвиток нових технологічних процесів, що здешевлюють продукт, і підприємництва.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Металічний зв'язок — особливий вид зв'язку, що утворюється від взаємодії вільних електронів з йонами металічних елементів.
• Металічний зв'язок виникає в простих речовинах, утворених металічними елементами.
• Механізм утворення металічного зв'язку полягає у втраті атомами електронів. Унаслідок цього у вузлах кристалічних ґраток розміщуються тільки позитивно заряджені йони, які щільно упаковуються один біля одного. Зв'язок між ними здійснюється завдяки безперервному руху електронів (електронного газу).
• Металічний зв'язок відрізняється від йонного тим, що у вузлах кристалічних ґраток металів є тільки позитивно заряджені йони, а в йонних сполуках чергуються позитивно й негативно заряджені йони.
• Металічний зв'язок відрізняється від ковалентного тим, що всі електрони не утримуються біля окремих атомів (йонів), а вільно переміщаються, здійснюючи зв'язок між усіма атомами (йонами).
• Наявність металічного зв'язку впливає на властивості металів.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Поясніть, який зв'язок називають металічним.
- 2. Наведіть приклади речовин, у яких наявний металічний зв'язок.
- 3. Поясніть подібність і відмінність зв'язків: а) ковалентного й металічного; б) йонного та металічного.
- 4. Обґрунтуйте залежність властивостей металів від їхньої будови.
- 5. Класифікуйте наведені речовини за видами хімічного зв'язку: а) ковалентний неполярний; б) ковалентний полярний; в) йонний; г) металічний; ґ) ковалентний полярний і водневий.
Na2S, H2S, Cl2, HCl, Mg, CaCl2, H2, CH3CH2OH, Na, H2O, NH3, Br2, CH3CH2COOH, Cu, FeBr2, I2, H2Se, CuBr2, CH3OH, N2, SO2.
Коментарі (0)