Окисні й відновні властивості неметалів
- 16-11-2023, 14:03
- 343
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 18. ОКИСНІ Й ВІДНОВНІ ВЛАСТИВОСТІ НЕМЕТАЛІВ
Опанувавши матеріал параграфа, ви зможете:
- називати неметали;
- характеризувати неметали, їхні фізичні й хімічні властивості;
- складати рівняння, що підтверджують окисні властивості неметалів під час взаємодії з воднем і металами; відновні властивості водню й вуглецю в реакціях з оксидами металічних елементів;
- висловлювати судження щодо окисних і відновних властивостей неметалів під час окисно-відновних процесів та їхнього значення.
Неметали. Усі хімічні елементи умовно поділяють на металічні й неметалічні, а їхні прості речовини — на метали й неметали. Неметалів значно менше, ніж металів. Ви вже ознайомилися з деякими неметалами, вивчаючи алотропні модифікації неметалічних елементів. Прості речовини-неметали, утворені елементами першого періоду, — це водень і гелій та в підгрупах — вуглець, силіцій, азот і фосфор, кисень і сірка, галогени й інертні гази. За звичайних умов неметали перебувають у трьох агрегатних станах (табл. 9).
Таблиця 9
Агрегатний стан неметалів
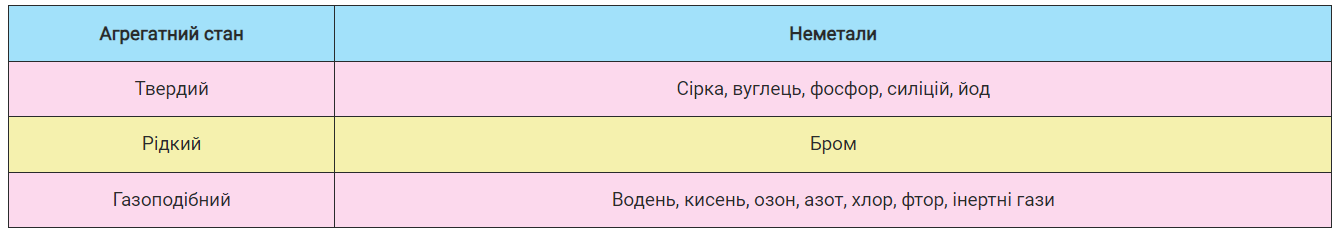
Фізичні властивості. Неметали — це речовини, що не проводять тепло й електричний струм, крім силіцію (напівпровідний) і графіту, який проводить електричний струм. Температури плавлення та кипіння залежать від їхнього агрегатного стану. Найнижчі температури кипіння мають гази. Тверді речовини крихкі, різного забарвлення: сірка — жовтого кольору; фосфор, залежно від алотропної модифікації, — білого, червоного або чорного; йод — фіолетового, має металічний блиск; вуглець — сіро-чорного.
Для сірки характерне явище флотації, тобто незмочування водою. Якщо порошок сірки насипати у воду, то він плаватиме на її поверхні. Сірка легкоплавка, температура кипіння становить 444,6 °С.
Газам теж властивий певний колір: кисень, водень й азот — безбарвні речовини, без запаху; хлор — жовто-зеленого кольору, з різким запахом. Це дуже отруйний газ, вдихання якого викликає параліч верхніх дихальних шляхів. Бром — летка рідина, швидко перетворюється на пару бурого кольору з різким запахом. За потрапляння на шкіру спричиняє опіки. Йоду властива сублімація, тобто з підвищенням температури переходить з твердого стану в газоподібний (рис. 35).

Рис. 35. Сублімація йоду
Хімічні властивості неметалів. Розглянемо прості речовини-неметали з погляду окисно-відновних процесів. Зважаючи на те, що атоми неметалічних елементів приєднують електрони, ці речовини під час хімічних реакцій є окисниками. Найбільш виражені окисні властивості проявляють фтор, кисень, хлор.
Окисні властивості кисню. Кисень у реакціях з металами й воднем проявляє окисні властивості. Наприклад:
![]()
Напишіть самостійно перехід електронів у реакції водню з киснем, назвіть окисник і відновник.
Окисні властивості сірки. З металами й воднем сірка теж проявляє окисні властивості. З активними металами вона взаємодіє за звичайної температури. Рівняння реакції:
![]()
Реакція з алюмінієм відбувається лише за нагрівання:
![]()
З воднем сірка взаємодіє за підвищеної температури:
![]()
Окисні властивості вуглецю. Усі алотропні модифікації Карбону — це вуглець, тож для них характерні однакові хімічні властивості. Як малоактивний неметал, вуглець вступає в хімічну взаємодію тільки за високих температур. У реакціях з воднем і металами проявляє окисні властивості. Рівняння реакцій:
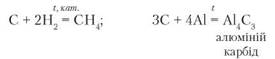
Складіть самостійно рівняння реакцій взаємодії вуглецю з кальцієм і магнієм. Визначте окисник і відновник.
Окисні властивості хлору. Як неметал, хлор проявляє окисні властивості, реагуючи з воднем і менш хімічно активними неметалами. Реакція взаємодії хлору з воднем відбувається за нагрівання або освітлення:
Cl2 + H2 = 2HCl.
У хлорі загоряється фосфор. Під час горіння утворюються фосфор(ІІІ) і фосфор(V) хлориди відповідно:
2Р + 3Сl2 = 2РСl3; 2Р + 5Сl2 = 2РСl5.
Хлор активно реагує з металами, унаслідок чого утворюються солі — хлориди. Наприклад:
2Na + Cl2 = 2NaCl; Zn + Cl2 = ZnCl2.
У реакціях з металами залізом і хромом хлор окиснює їх до ступеня окиснення +3. Рівняння реакцій:
2Fe + 3Cl2 = 2FeCl3; 2Cr + 3Cl2 = 2CrCl3.
Окисні властивості з металами проявляє фосфор. Наприклад:
3Na + P = Na3P; 3Mg + 2P = Mg3P2.
Відновні властивості водню. Водень є добрим відновником. Під час реакції з киснем горить блакитним полум'ям. У суміші з киснем 1 : 2 і з повітрям 1 : 5 — вибухонебезпечний. Рівняння реакції:
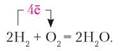
Крім кисню, реагує з фтором, хлором, сіркою та азотом.
Складіть самостійно рівняння реакцій взаємодії водню з фтором, хлором і сіркою. Назвіть окисник і відновник.
Надзвичайно важливою в металургії є здатність металів відновлюватися з їхніх оксидів. Наприклад:
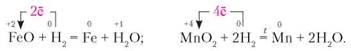
Відновні властивості вуглецю. У реакціях з хімічно активними неметалами вуглець є відновником. Наприклад:
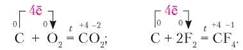
Як і водень, вуглець використовують у металургії для відновлення металів з їхніх оксидів. За участю вуглецю метал відновлюється до вільного стану. Наприклад:
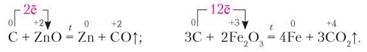
Складіть самостійно рівняння реакцій взаємодії вуглецю з купрум(ІІ) оксидом і карбон(IV) оксидом.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Прості речовини неметалічних елементів називають неметалами.
• До неметалів належать водень і гелій та в підгрупах — вуглець, силіцій, азот і фосфор, кисень і сірка, галогени й інертні гази.
• За звичайних умов неметали перебувають у трьох агрегатних станах: твердому, рідкому й газоподібному.
• Неметали не мають металічного блиску, не проводять електричного струму й тепла, мають низькі температури плавлення та кипіння, різне забарвлення. Деякі (білий фосфор, хлор, бром) — отруйні.
• Неметали під час хімічних перетворень проявляють окисні й відновні властивості. Окисні властивості неметали проявляють у реакціях з іншими неметалами й металами. Відновні властивості проявляють водень і вуглець у реакціях з оксидами металічних елементів.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Назвіть найпоширеніші в природі неметалічні елементи та прості речовини, які вони утворюють.
- 2. Охарактеризуйте фізичні властивості неметалів.
- 3. Напишіть рівняння реакцій між речовинами, визначте окисник і відновник:
а) ZnO + C = ... ;
б) Fe2O3 + H2 = ... ;
в) MoO3 + H2 = ... ;
г) Cr2O3 + Al = ... ;
ґ) ZnO + CO = ... ;
д) Fe2O3 + C = ... ;
е) V2O5 + C = ... ;
є) CuO + H2 = ... .
- 4. Укажіть кількість електронів, що зміщуються до атома Оксигену в реакції:
С + О2 = СО2.
А 2
Б 6
В 8
Г 4
- 5. Позначте елемент, що окиснюється, й елемент, що відновлюється, у реакції:
3Н2+ N2 = 2NH3.
А Нітроген окиснюється
Б Нітроген відновлюється
В Гідроген окиснюється
Г Гідроген відновлюється
- 6. Обчисліть масу й об'єм (н. у.) реагентів, якщо під час реакції утворився фосфор(V) хлорид масою 41,7 г.
- 7. Унаслідок реакції ферум(ІІІ) оксиду з воднем отримали залізо масою 44,8 г. Обчисліть, яка маса ферум(ІІІ) оксиду й об'єм водню (н. у.) прореагували. Обчисліть кількість речовини, якій відповідає маса утвореного заліза.
- 8. На відновлення мангану з манган(IV) оксиду витратили водень об'ємом 15,68 л (н. у.). Обчисліть масу манган(IV) оксиду, що прореагував, і маси продуктів реакції.
- 9. На відновлення хрому з хром(ІІІ) оксиду витратили вуглець кількістю речовини 0,9 моль. Обчисліть масу відновленого хрому й об'єм (н. у.) утвореного газу, масу та кількість речовини хром(ІІІ) оксиду, яку відновили.
Коментарі (0)