Алотропія. Алотропні модифікації неметалічних елементів
- 16-11-2023, 14:00
- 391
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 16. АЛОТРОПІЯ. АЛОТРОПНІ МОДИФІКАЦІЇ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ
Опанувавши матеріал параграфа, ви зможете:
- пояснювати суть явища алотропії; відмінності властивостей алотропних модифікацій Оксигену, Сульфуру, Карбону й Фосфору за допомогою їхнього кількісного складу або будови;
- досліджувати адсорбційну здатність активованого вугілля й аналогічних лікарських препаратів;
- обґрунтовувати значення алотропних перетворень;
- доводити практичну значущість явища адсорбції;
- висловлювати судження щодо біологічної ролі озону та його застосування.
Алотропія. У § 15 згадувалося про те, що неметалічні елементи можуть утворювати декілька простих речовин, відмінних за складом молекул і будовою.
• Алотропія (від грецьк. allos — інший, tropos — властивість) — явище утворення хімічним елементом двох або більше простих речовин, різних за властивостями та будовою. Прості речовини одного елемента називають алотропними модифікаціями.
Алотропні модифікації властиві Оксигену, Сульфуру, Карбону та Фосфору. Ознайомимося докладніше з простими речовинами кожного з цих елементів.
Алотропні модифікації Оксигену. Оксиген утворює дві прості речовини: кисень та озон. Порівняємо їхній склад і властивості (табл. 5).
Таблиця 5
Порівняльна характеристика кисню й озону
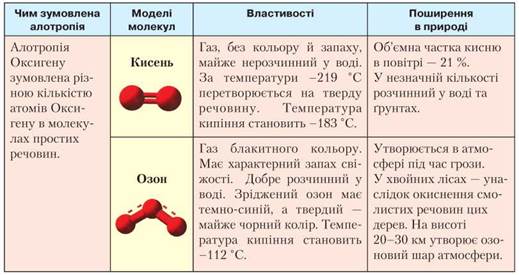
Кисень під дією високої температури, електричного розряду або ультрафіолетового випромінювання перетворюється на озон, що відображає рівняння:
![]()
Реакція оборотна, тобто утворений озон розкладається до кисню й атомарного Оксигену. Оксиген сполучається в молекули кисню. Цей процес відображає рівняння:
![]()
або сумарно:
![]()
Кисень й озон відрізняються хімічною активністю. Вам уже відомо, що кисень є добрим окисником під час реакцій з металами й деякими неметалами. Однак реакційна здатність озону значно вища завдяки тому, що під час його розпаду утворюється атомарний Оксиген. Це зумовлює самозаймання деяких речовин в озоні, знебарвлення барвників, крихкість каучуків.
Наявність кисню в повітрі забезпечує всі життєві процеси в живих організмах. Завдяки кисню відбувається процес дихання. Однак надмірна його кількість в організмі призводить до пришвидшення обмінних процесів, що спричиняє зношування організму. Кисень застосовують для різання та зварювання металів у суміші з етином (ацетиленом) і як окисник палива в ракетних двигунах. У медицині киснем наповнюють кисневі подушки для хворих, у яких утруднене дихання.
Озон — отруйна речовина, але в малій кількості є добрим антисептиком, тому його застосовують для озонування води й повітря. У суміші з киснем використовують як окисник ракетного палива; для відбілювання тканин.
Озоновий шар захищає Землю від сонячної радіації.
У промисловості кисень добувають зі зрідженого повітря, перегонкою або електролізом води. У лабораторних умовах — розкладом оксигеновмісних речовин, зокрема калій перманганату KMnO4, гідроген пероксиду H2O2, калій хлорату KClO3, натрієвої NaNO3 чи калієвої KNO3 селітр.
Складіть самостійно рівняння реакцій електролізу води й розкладу оксигеновмісних органічних речовин, які ви вивчали в попередніх класах.
Алотропні модифікації Сульфуру. Сульфур — елемент 3 періоду головної підгрупи VI групи. На зовнішньому (третьому) енергетичному рівні його атома міститься 6 електронів. Електронна конфігурація атома — 3s23p4.
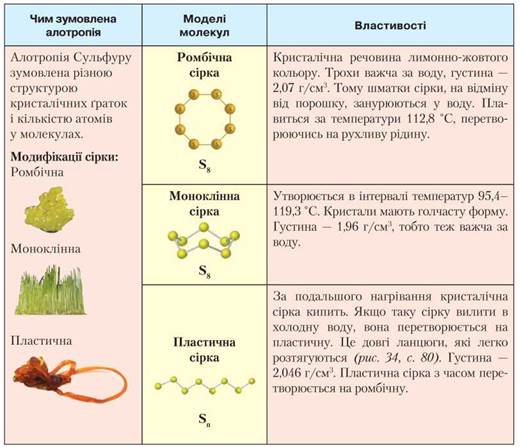
Сульфур утворює декілька алотропних модифікацій, зокрема кристалічну та пластичну сірку. Кристалічна сірка має дві форми: ромбічну та моноклінну. Ознайомимося з ними докладніше (табл. 6).
Таблиця 6
Порівняльна характеристика алотропних модифікацій Сульфуру
Сірка набула широкого застосування в різних галузях виробництва. Зокрема в промисловості органічного синтезу — для вулканізації каучуку, у виробництві сірників, отрутохімікатів, які використовують у боротьбі з хворобами та шкідниками рослин (бавовнику, виноградної лози). Її застосовують як антисептик у фармацевтичній промисловості для виробництва мазей (наприклад, сірчаної мазі для лікування захворювань шкіри). У хімічній промисловості — для виробництва сульфатної кислоти та її солей.

Рис. 34. Процес перетворення кристалічної сірки на пластичну
Алотропні модифікації Фосфору. Фосфор — елемент 3 періоду, головної підгрупи V групи. Тому зовнішній (третій) енергетичний рівень його атома має електронну конфігурацію 3s23p3.
За звичайних умов фосфор є твердою речовиною, пара якої містить молекули Р4. У природі у вільному стані не трапляється.
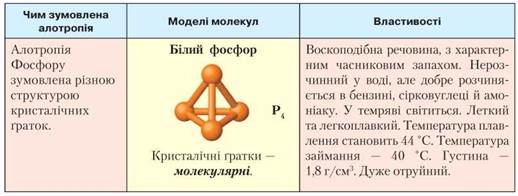
Фосфор утворює три алотропні модифікації: білий, червоний та чорний (табл. 7). Як і всі неметали, реагує з киснем. Білий фосфор — активніше, і вже за температури 50 °С загоряється в повітрі. Менш активний червоний фосфор горить у надлишку кисню, якщо його підпалити. Рівняння реакції:
4Р + 5О2 = 2Р2О5.
Таблиця 7
Порівняльна характеристика алотропних модифікацій Фосфору
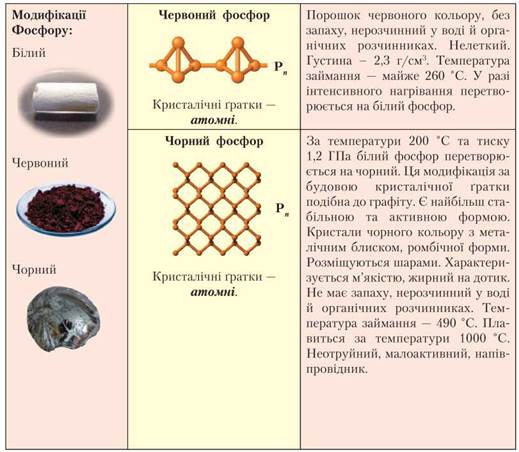
Продовження табл. 7
Алотропні модифікації Карбону. Карбон — елемент 2 періоду головної підгрупи IV групи. Тому зовнішній (другий) енергетичний рівень його атома має електронну конфігурацію 2s22p2. Завдяки особливій будові атомів Карбону він існує у вигляді декількох алотропних модифікацій — як природних, так і штучно добутих.
У курсі хімії 8 класу ви вивчили кристалічну будову та фізичні властивості однієї з алотропних модифікацій Карбону — алмазу. Алмаз і графіт — це природні модифікації Карбону, кристалічні структури яких різко відрізняються. Крім них, відомі карбін і фулурен. Пригадаємо деякі властивості алмазу та графіту.
Алмаз (від грецьк. adamas — твердий) — природна модифікація з атомними кристалічними ґратками, найтвердіший серед інших речовин. Це безбарвні прозорі кристали, які не змочуються водою. Дуже тугоплавкий, з температурою плавлення 4000 °С. Не проводить електричного струму, але добре проводить тепло. Якщо діяти на алмаз рентгенівським чи ультрафіолетовим промінням, то він світиться блакитним або жовтим світлом. Характерною властивістю алмазу є здатність добре заломлювати світло, розкладаючи його на цілий спектр кольорів. Завдяки цьому алмази застосовують у ювелірній справі. Алмази не розчиняються ні в кислотах, ні в інших сильних розчинниках.
Графіт (від грецьк. grafo — пишу) — речовина сірого або чорного кольору, з металічним блиском, непрозора, жирна на дотик. Належить до тугоплавких сполук, з температурою плавлення 3800 °С. Порівнюючи з алмазом, графіт м'який, добре проводить електричний струм і теплоту.
Алмаз і графіт можуть взаємоперетворюватися. За нагрівання алмазу до температури понад 1000 °С без доступу повітря він перетворюється на графіт. За вищих температур (1200-1600 °С) і наявності каталізатора графіт перетворюється на алмаз. Цю властивість узято за основу виготовлення штучних алмазів.
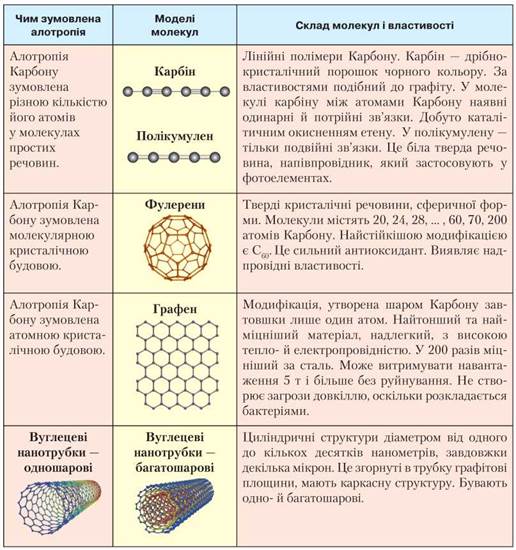
З іншими алотропними модифікаціями Карбону ознайомимося за табл. 8.
Таблиця 8
Алотропні модифікації Карбону

Розалінд Елсі Франклін (1920-1958) — британська вчена-біофізик і кристалограф. Створила підґрунтя для висунення гіпотези про структуру подвійної спіралі молекули ДНК, що в 1953 р. задекларували американські вчені Дж. Ватсон і Ф. Крік.
Керуючись бажанням зробити свій внесок у перемогу в Другій світовій війні, із серпня 1942 р. працювала в Британській дослідницькій асоціації з використання вугілля й вивчала його пористу структуру. Її робота сприяла зародженню ідеї про високоміцне вуглецеве, або графітове, волокно — штучне волокно, що складається з вуглецю й має графітову структуру, тобто атоми Карбону розташовані в тонкі довгі графітові волокна. Ця ідея була основою її докторської дисертації «Фізична хімія твердих органічних колоїдів на прикладі вугілля і пов'язаних з ним матеріалів».
Отже, неметалічні елементи Оксиген, Сульфур, Фосфор і Карбон утворюють по декілька простих речовин — алотропних модифікацій, які набули застосування в техніці, медицині, ювелірній справі, металургії, виробництві гуми, очищенні води. У перспективі — широке використання фулеренів, графену, вуглецевих нанотрубок у медицині та лазерній техніці.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Неметалічні елементи здатні утворювати по декілька простих речовин. Прості речовини одного й того самого елемента називають алотропними модифікаціями. Суть явища алотропії полягає в утворенні кількох простих речовин тим самим хімічним елементом.
• Алотропні модифікації утворюють елементи Оксиген, Сульфур, Карбон і Фосфор. Алотропія Оксигену зумовлена різною кількістю атомів у молекулах простих речовин, а Сульфуру, Фосфору й Карбону — різною структурою кристалічних ґраток.
• Алотропними модифікаціями Оксигену є кисень й озон, які здатні взаємоперетворюватися за певних умов. Це два гази: кисень — без запаху й кольору; озон — з характерним запахом свіжості, блакитного кольору. Кисень — добрий окисник, однак окисні властивості озону значно більші. Кисень забезпечує життєві процеси, озон — отруйний.
• Алотропними модифікаціями Сульфуру є кристалічна та пластична сірка. Кристалічна сірка має дві форми: ромбічну й моноклінну. Ромбічна сірка — речовина лимонно-жовтого кольору, яка за температури 95,4-119,3 °С перетворюється на моноклінну. Ромбічна сірка утворює кристали ромбічної форми, моноклінна — голчасті кристали. За подальшого нагрівання кристалічна сірка кипить і, якщо її вилити в холодну воду, вона перетворюється на пластичну. Це довгі ланцюги, які легко розтягуються.
• Алотропні модифікації Фосфору: білий, червоний та чорний фосфор. У білого фосфору кристалічна ґратка молекулярна, у червоного та чорного — атомна. Молекули білого фосфору чотириатомні Р4, червоного й чорного — мають велику кількість атомів (відображають формулою Рn).
• Усі три модифікації за певних умов взаємоперетворюються одна на одну. Білий фосфор має характерний часниковий запах, отруйний, світиться в темряві, а дві інші модифікації — без запаху, не отруйні, не світяться.
• Алотропні модифікації Карбону: алмаз, графіт, карбін, фулерени. Алмазу властива висока твердість і водночас крихкість. На відміну від нього графіт м'який. Алмаз і графіт — тугоплавкі, взаємоперетворюються за певних умов.
• Карбін і полікумулен — лінійні полімери Карбону, що відрізняються видами хімічних зв'язків між атомами Карбону. У карбіну — одинарні й потрійні, у полікумулену — тільки подвійні. Це тверді речовини, напівпровідники.
• Фулерени — алотропні модифікації Карбону, тверді кристалічні речовини. Молекули містять 20, 24, 28, ... 60, 70, 200 атомів Карбону. Найстійкішою модифікацією є С60, сферичної форми. Це сильний антиоксидант. Проявляє надпровідні властивості.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Поясніть суть явища алотропії на прикладах.
- 2. Охарактеризуйте алотропні модифікації: а) Оксигену; б) Сульфуру; в) Фосфору; г) Карбону.
- 3. Складіть рівняння реакцій: а) сірки з магнієм, алюмінієм, воднем, киснем; б) кисню з міддю, воднем; в) фосфору з киснем, сіркою, кальцієм; г) вуглецю з воднем, киснем, ферум(ІІ) оксидом, хром(ІІІ) оксидом. Розгляньте реакції як окисно-відновні.
- 4. Позначте прості речовини, що є алотропними модифікаціями одного елемента.
А сірка, сульфур(IV) оксид
Б бор, бор оксид
В алмаз, фулерен
Г карбон, карбон(IV) оксид
- 5. Укажіть модифікацію Карбону, твердішу за сталь.
А фулерен
Б алмаз
В графен
Г графіт
- 6. Укажіть просту речовину, що світиться в темряві.
А пластична сірка
Б червоний фосфор
В алмаз
Г білий фосфор
- 7. Позначте окисник і відновник у реакції, що відбувається за схемою:
ZnO + C → Zn + CO2↑.
А відновник С+2
Б окисник Zn0
В окисник Zn+2
Г відновник С0
- 8. Під час згоряння вуглецю в атмосфері кисню утворився карбон(IV) оксид об'ємом 112 л (н. у.). Обчисліть масу вуглецю й об'єм кисню, що прореагували.
- 9. У лабораторії провели експеримент на відновні властивості водню. Крізь порошок купрум(ІІ) оксиду масою 1,6 г пропустили водень у надлишку. Обчисліть об'єм водню (н. у.), що витратився, і масу та кількість речовини міді, що утворилася.
- 10. Цинк оксид масою 32,4 г повністю відновили вуглецем. Обчисліть масу цинку та об'єм карбон(IV) оксиду (н. у.), що утворилися. Якій кількості речовини відповідає такий об'єм?
ЦІКАВО ЗНАТИ
• Міцність та інші унікальні властивості графену матимуть широке застосування в майбутньому. Це створення гнучких та ударостійких екранів телефонів, куленепроникних желетів, легкого й міцного матеріалу для авто-, літако- й ракетобудування. Зокрема, компанія Samsung запатентувала графеновий акумулятор, який забезпечує високу швидкість зарядки та збільшує електричну ємність батарей. Графенові акумулятори використовуватимуть в електромобілях. Немале значення матиме застосування графену в медицині. Уводячи його в клітини організму, лікарі зможуть спостерігати за організмом ізсередини за допомогою нанобітів. Оскільки виробництво графену дороге, триває пошук способів здешевлення цього унікального матеріалу.
• На думку вчених, відкриття нанотрубок є початком ще однієї технічної революції. Триває активна робота з побудови нанороботів-реплікаторів, які могли б перемагати інфекційні, хронічні й генетичні хвороби організму. Наноробот-реплікатор за індивідуальною програмою керування на молекулярному рівні зможе відшукати збудника хвороби та знешкодити його.
Коментарі (0)