Сполуки неметалічних елементів з Гідрогеном
- 16-11-2023, 14:05
- 4 832
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 21. СПОЛУКИ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ З ГІДРОГЕНОМ
Опанувавши матеріал параграфа, ви зможете:
- називати сполуки неметалічних елементів з Гідрогеном;
- наводити приклади сполук неметалічних елементів з Гідрогеном (гідроген хлорид, гідроген сульфід, амоніак);
- складати рівняння реакцій, які характеризують особливості водних розчинів гідроген хлориду (з основами), гідроген сульфіду (з лугами) й амоніаку (з кислотами);
- характеризувати застосування гідроген хлориду, гідроген сульфіду й амоніаку;
- порівнювати особливості водних розчинів гідроген хлориду, гідроген сульфіду й амоніаку.
Сполуки неметалічних елементів з Гідрогеном. Вам уже відомо, що неметалічні елементи з Гідрогеном утворюють леткі сполуки. Це елементи IV-VII груп періодичної системи (табл. 12).
Таблиця 12
Леткі сполуки неметалічних елементів з Гідрогеном
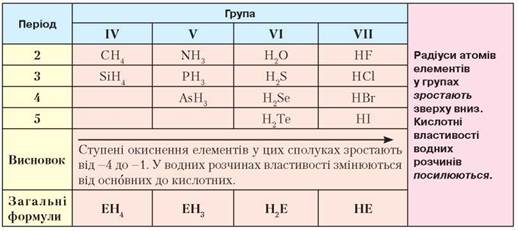
Проаналізувавши табл. 12, зробимо висновок: залежно від кількості неспарених електронів на зовнішньому енергетичному рівні, атоми неметалічних елементів утворюють ковалентні полярні зв'язки з різною кількістю атомів Гідрогену. Елементи IV групи періодичної системи утворюють чотири зв'язки, V — три, VI — два, VII групи — один зв'язок.
Леткі сполуки неметалічних елементів з Гідрогеном переважно проявляють здатність розчинятися у воді. Ознайомимося докладніше з механізмами розчинення гідроген хлориду НСl, гідроген сульфіду H2S та амоніаку NH3 у воді.
Запишемо рівняння реакції взаємодії гідроген хлориду з водою:
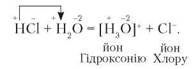
Якщо розчин гідроген хлориду у воді випробувати лакмусом, то забарвлення індикатора зміниться на червоне. Це вказує на те, що утворилася кислота.
З рівняння бачимо, що атом Оксигену має більший заряд, ніж атом Хлору. Тому атом Оксигену з більшою силою притягує атоми Гідрогену. Під час розчинення йон Гідрогену відщеплюється від Хлору й завдяки наявності вільної електронної пари приєднується до Оксигену. Утворюється йон Гідроксонію Н3О+. Оксиген на утворення зв'язку віддав електронну пару, тому є донором, а йон Гідрогену — акцептором. Отже, механізм утворення ковалентного зв'язку в цьому випадку є донорно-акцепторним (див. § 5).
Тепер з'ясуємо, як відбувається розчинення амоніаку у воді. Під час цієї реакції атом Нітрогену міцніше втримує атоми Гідрогену, ніж атом Оксигену. Нітроген, який має вільну електронну пару, притягує йон Гідрогену від Оксигену. Утворюється позитивно заряджений йон амонію:
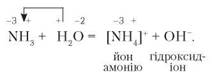
За рівнянням можна припустити, що наявність у розчині гідроксид-іонів зумовлює лужне середовище. Наявність лугу виявляють індикатором. Розчин фенолфталеїну набуває малинового забарвлення.
Поясніть механізм утворення зв'язку під час розчинення амоніаку у воді.
Гідроген сульфід у водному розчині поводиться як дуже слабка кислота. Оксиген і Сульфур — елементи головної підгрупи VI групи. Водночас Оксиген проявляє більшу електронегативність, ніж Сульфур, оскільки в головних підгрупах електронегативність елементів зростає знизу вверх. Тому йон Гідрогену від гідроген сульфіду приєднується до Оксигену за рахунок вільної електронної пари. Рівняння реакції:
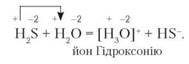
Отже, зважаючи на розглянуті приклади розчинення летких сполук неметалічних елементів з Гідрогеном, зробимо такі висновки:
• у періодах зліва направо послаблюються основні властивості водних розчинів неметалічних елементів з Гідрогеном і посилюються кислотні;
• у групах зверху вниз зростають радіуси атомів, тому зв'язок між атомом неметалічного елемента й Гідрогеном послаблюється; кислотні властивості водних розчинів посилюються.
Властивості водних розчинів сполук неметалічних елементів з Гідрогеном. Вивчаючи розчинення у воді сполук неметалічних елементів з Гідрогеном, ви переконалися, що їхні розчини можуть проявляти властивості кислот або основ. Перевіримо це, проводячи досліди.
Дослід 1. Наллємо в пробірку розчин натрій гідроксиду, підфарбований фенолфталеїном, і доллємо до нього хлоридну кислоту. Спостерігатимемо знебарвлення розчину: хлоридна кислота нейтралізувала луг. Рівняння реакції:
NaOH + HCl = NaCl + H2O.
Складіть самостійно йонне рівняння реакції. Поясніть, які йони взяли участь у реакції.
Хлоридна кислота реагує з нерозчинними основами, утворюючи сіль і воду. Щоб переконатися в цьому, проведемо дослід.
Дослід 2. Добудемо купрум(ІІ) гідроксид реакцією обміну:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4.
Унаслідок реакції випадає в осад нерозчинна основа синього кольору. Доллємо до пробірки з осадом хлоридну кислоту:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O.
Осад розчиняється, а розчин набуває блакитного кольору. Такого забарвлення йому надає купрум(ІІ) хлорид.
Як слабка кислота, водний розчин гідроген сульфіду реагує тільки з лугами. Цю реакцію відображає рівняння:
2NaOH + H2S = Na2S + 2H2O.
Якщо ж гідроген сульфід узято в надлишку, утворюється натрій гідрогенсульфід — кисла сіль складу NaHS:
NaOH + H2S = NaHS + H2O.
Взаємодію амоніаку з хлоридною кислотою спостерігатимемо на досліді «дим без вогню».
Дослід 3. Візьмемо два концентровані розчини: амоніаку й гідроген хлориду. Опустимо в кожний розчин скляну паличку, а потім наблизимо палички одну до одної. З'являється густий білий «дим». Цей «дим» є скупченням дрібних кристалів утвореної солі — амоній хлориду:
NH4OH + HCl = NH4Cl + H2O.
Взаємодія амоній гідроксиду з кислотами вказує на те, що водний розчин амоніаку є основою.
Отже, зважаючи на проведені досліди, зробимо висновок: водні розчини летких сполук неметалічних елементів з Гідрогеном проявляють властивості кислот або основ.
Застосування сполук неметалічних елементів з Гідрогеном. Леткі сполуки неметалічних елементів з Гідрогеном, розчиняючись у воді, утворюють основи або кислоти.
Гідроген хлорид — газ, який отримують під час нагрівання натрій хлориду з концентрованою сульфатною кислотою. Рівняння реакції:
![]()
Водний розчин гідроген хлориду — хлоридна (соляна) кислота. Якщо масова частка гідроген хлориду у водному розчині становить 34-36 %, то його називають концентрованою хлоридною кислотою.
Отже, гідроген хлорид насамперед використовують для добування хлоридної кислоти та її солей — хлоридів. Крім того, гідроген хлорид набув широкого застосування в органічному синтезі.
Гідроген сульфід — газ, без кольору, важчий за повітря, з характерним неприємним запахом тухлих яєць, отруйний. Точніше, зіпсовані яйця виділяють гідроген сульфід, що дає такий запах. Водний розчин гідроген сульфіду змінює колір лакмусу на червоний, тому його називають сульфідною кислотою. Найчастіше застосовують солі — сульфіди, які входять до складу сульфідних руд.
Амоніак як сполука Нітрогену з Гідрогеном — газ з різким запахом, який широко використовують у різних галузях промислового виробництва (рис. 38).
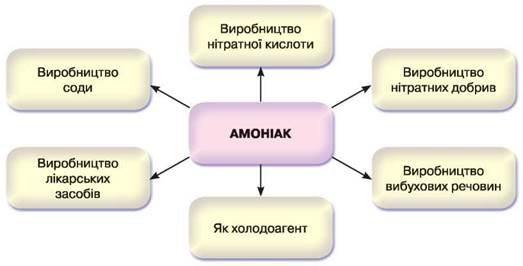
Рис. 38. Схема застосування амоніаку
Пригадайте з курсу органічної хімії застосування метану та складіть самостійно схему.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Елементи IV—VII груп періодичної системи утворюють леткі сполуки неметалічних елементів з Гідрогеном.
• Загальні формули летких сполук неметалічних елементів з Гідрогеном: ЕН4, ЕН3, Н2Е, НЕ. Ступені окиснення елементів у цих сполуках зростають від -4 до -1.
• Леткі сполуки неметалічних елементів з Гідрогеном загалом проявляють здатність розчинятися у воді. У періодах зліва направо властивості водних розчинів змінюються від основних до кислотних. У групах, зі зростанням радіусів атомів зверху вниз, кислотні властивості водних розчинів посилюються.
• Властивості водних розчинів летких сполук неметалічних елементів з Гідрогеном змінюються так: гідроген хлорид у водному розчині — сильна неорганічна кислота, гідроген сульфід — слабка кислота й амоніак — нестійка слабка основа.
• Сполуки неметалічних елементів з Гідрогеном набули застосування в різних галузях промислового виробництва України.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Назвіть неметалічні елементи, що утворюють леткі сполуки з Гідрогеном.
- 2. Поясніть механізм розчинення у воді: а) гідроген хлориду; б) гідроген сульфіду; в) амоніаку.
- 3. Складіть рівняння реакцій водних розчинів: а) гідроген хлориду з калій, кальцій та ферум(ІІ) гідроксидами; б) гідроген сульфіду з барій гідроксидом; в) амоніаку із сульфатною кислотою. Назвіть утворені продукти реакцій.
- 4. Загальна формула сполуки ЕН3. До її складу входить Гідроген, масова частка якого становить 17,65 %. Виведіть формулу сполуки.
- 5. Унаслідок взаємодії натрій гідроксиду з гідроген сульфідом утворилася середня сіль масою 31,2 г. Обчисліть маси реагентів.
- 6. Крізь сульфатну кислоту пропустили амоніак об'ємом 84 л (н. у.) з масовою часткою домішок 20 %. Обчисліть масу утвореної середньої солі, назвіть її.
- 7. Гідроген хлорид масою 24,333 г з масовою часткою домішок 0,1 прореагував з алюміній гідроксидом до утворення середньої солі. Обчисліть маси продуктів реакції та назвіть їх.
Коментарі (0)