Кислоти
- 16-11-2023, 14:06
- 402
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 22. КИСЛОТИ
Опанувавши матеріал параграфа, ви зможете:
- називати представників кислот за систематичною номенклатурою;
- складати рівняння реакцій, які характеризують хімічні властивості та добування кислот;
- характеризувати хімічні властивості кислот;
- прогнозувати перебіг хімічних реакцій, що характеризують хімічні властивості кислот;
- робити висновки про кислоти, їхню роль у промисловості.
Кислоти. Вам уже відомо, що під час реакцій взаємодії сполук неметалічних елементів з водою утворюються кислоти. Водночас, хоча силіцій(IV) оксид нерозчинний у воді, проте силікатна кислота існує. До складу її молекул, як і в інших кислот, входять атоми Гідрогену та кислотні залишки. Повторимо склад і назви кислот (табл. 13).
Таблиця 13
Склад і назви кислот і кислотних залишків, класифікація кислот
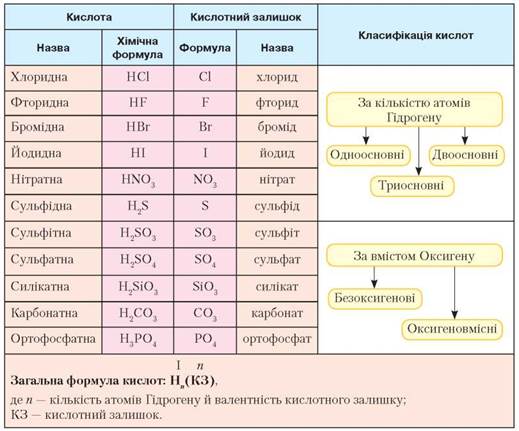
• Кислоти — це складні речовини, молекули яких містять один або декілька атомів Гідрогену й кислотні залишки.
Загальні хімічні властивості кислот. Властивості речовин залежать від їхнього складу та будови. Усі кислоти (крім силікатної) — молекулярні речовини. Спільним у їхньому складі є наявність атомів Гідрогену. Це й зумовлює загальні хімічні властивості кислот.
Дія на індикатори. Якщо до хлоридної, розчинів нітратної та сульфатної кислот долити по черзі розчини індикаторів: лакмусу, метилового оранжевого та фенолфталеїну, спостерігатимемо деякі зміни (табл. 14, с. 108).
Таблиця 14
Зміна забарвлення індикаторів у кислотах
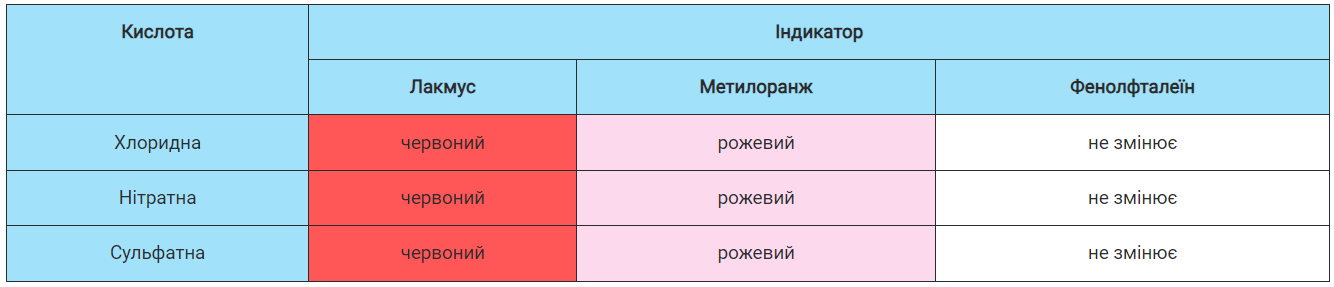
Отже, у кислотах лакмус і метилоранж змінюють забарвлення на червоне та рожеве відповідно. Фенолфталеїн на кислотне середовище не реагує. Зміна забарвлення індикаторів у кислотах є властивістю, завдяки якій кислоту можна виявити серед інших речовин.
Взаємодія кислот з металами. Дослідимо, як кислоти реагують з металами. До порцій металів магнію, цинку, заліза та міді доливатимемо хлоридну та розчин сульфатної кислоти. У пробірках, де містяться магній, цинк і залізо, під час доливання хлоридної та розчину сульфатної кислот виділяються бульбашки газу. У пробірках з міддю зміни не спостерігаються.
Запишемо рівняння реакцій, що відбуваються між металами та кислотами:
Mg + 2HCl = MgCl2 + H2↑;
Zn + 2HCl = ZnCl2 + H2↑;
Fe + 2HCl = FeCl2 + H2↑;
Cu + 2HCl ≠;
Mg + H2SO4 = MgSO4 + H2↑.
Zn + H2SO4 (розв.) = ZnSO4 + H2↑.
Fe + H2SO4 (розв.) = FeSO4 + H2↑.
Cu + H2SO4 ≠.
Як бачимо, не всі метали взаємодіють з кислотами.
Якщо ж уважно спостерігати інтенсивність виділення газу та порівняти, то в пробірці з магнієм його виділяється найбільше, трохи слабше — у пробірці з цинком, ще слабше — із залізом.
Експериментальні дані навели вчених на думку, що метали проявляють різну хімічну активність. На основі досліджень учений М. Бекетов розмістив метали в ряд активності, або витискувальний ряд металів.

У цьому ряді метали, що розміщені до водню, витискують його з розчинів кислот (виняток — нітратна кислота). Метали від міді до золота з розчинами кислот не реагують. Починаючи з літію, кожний наступний метал проявляє меншу хімічну активність, ніж попередній.
Під час реакцій металів, що в ряді активності стоять до водню, крім водню, що відновлюється до вільного стану, утворюються солі відповідних металів.

Микола Бекетов (1827-1911) — видатний український та російський фізико-хімік. Закінчивши гімназію, вступив до Санкт-Петербурзького університету, а через два роки перевівся до Казанського університету. У 1849 р. отримав ступінь кандидата природничих наук. З 1855 по 1857 р. працював на кафедрі хімії Харківського університету, з 1858 р. — професором.
Створив теорію витіснення одних металів іншими, установив ряд активності металів, описав метод відновлення металів алюмінієм. Започаткував фізико-хімічну наукову школу, а в 1864 р. — фізико-хімічний відділ на базі Харківського університету. Працюючи в Харківському університеті, опублікував понад 80 наукових праць.
Взаємодія з основними оксидами. Кислоти вступають у реакції обміну з основними оксидами. Продуктами цих реакцій є сіль і вода. Щоб переконатися в цьому, проведемо дослід.
Дослід 1. Доллємо до чорного порошку купрум(ІІ) оксиду розчин сульфатної кислоти та трохи нагріємо. Утворюється прозорий розчин яскраво-синього забарвлення — купрум(ІІ) сульфат. Таке забарвлення мають солі Купруму. Рівняння реакції:
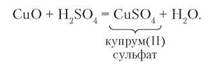
Складіть самостійно рівняння реакції взаємодії ферум(ІІІ) оксиду з хлоридною кислотою.
Взаємодія з основами. Кислоти мають здатність реагувати з основами, розчинними й нерозчинними у воді. Звернемося знову до досліду.
Дослід 2. Наллємо в пробірку розчин калій гідроксиду об'ємом 1,5-2 мл і додамо до нього декілька крапель фенолфталеїну. До цієї ж пробірки доллємо розчин нітратної кислоти.
Спрогнозуйте, як зміниться забарвлення індикатора та що відбудеться в пробірці після доливання розчину нітратної кислоти.
Отже, відбувається реакція нейтралізації. Калій гідроксид нейтралізується нітратною кислотою, унаслідок чого фенолфталеїн, який у лугах набуває малинового забарвлення, знебарвиться:
KOH + HNO3 = KNO3+ H2O.
Дослід 3. Добудемо ферум(ІІІ) гідроксид реакцією обміну. Для цього до розчину ферум(ІІІ) хлориду доллємо розчин натрій гідроксиду. Утворюється бурий осад ферум(ІІІ) гідроксиду (рис. 39, а, с. 110). Під час доливання до осаду хлоридної кислоти (рис. 39, б) осад розчиняється. Продуктом реакції є прозорий розчин ферум(ІІІ) хлориду (рис. 39, в).

Рис. 39. Розчинення ферум(ІІІ) гідроксиду під час взаємодії з хлоридною кислотою: а — ферум(ІІІ) гідроксид; б — хлоридна кислота; в — прозорий розчин ферум(ІІІ) хлориду
Взаємодія із солями. Кислоти реагують із солями за умови, коли випадає осад або виділяється газ.
Дослід 4. Подрібнимо шматок крейди (кальцій карбонат), насиплемо її на дно пробірки й доллємо розчин нітратної кислоти. Відбувається реакція з виділенням газу:
СаСО3 + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O.
Із солями реагують органічні кислоти, наприклад етанова кислота. Рівняння реакції:
Na2CO3 + 2CH3COOH → 2CH3COONa + CO2↑ + H2O.
Під час реакції натрій карбонату з етановою кислотою утворюється нова сіль і нестійка кислота, що розпадається на карбон(IV) оксид і воду.
Дослід 5. Наллємо в пробірку розчин барій хлориду об'ємом 1,5-2 мл і доллємо такий самий об'єм сульфатної кислоти. Випадає білий осад, нерозчинний у кислотах. Рівняння реакції:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl.
Підсумовуючи зазначене, зробимо висновок: кислоти — це речовини, що вступають у хімічну взаємодію з металами, які в ряді активності стоять до водню, а також з основними оксидами, розчинними й нерозчинними у воді основами та солями.
Добування кислот. Кислоти класифікують за вмістом Оксигену на безоксигенові й оксигеновмісні. Розглянемо способи їхнього добування.
Добування безоксигенових кислот. Вам уже відомо, що неметалічні елементи реагують за певних умов з воднем. Унаслідок взаємодії утворюються леткі сполуки неметалічних елементів з Гідрогеном. Наприклад:
H2 + Cl2 = 2HCl; H2 + S = H2S.
У § 21 ви вивчили механізм розчинення цих сполук у воді. Їхні водні розчини є кислотами. Зауважимо, що у воді розчиняються гідроген селенід H2Se і гідроген телурид H2Te, водні розчини яких проявляють більш виражені кислотні властивості порівняно з гідроген хлоридом. Сполуки HBr та HI безпосередньо за допомогою взаємодії простих речовин з воднем добути не можна, однак їхні розчини проявляють властивості кислот.
Добування оксигеновмісних кислот. Деякі оксигеновмісні кислоти добувають за допомогою взаємодії кислотних оксидів з водою. У цьому полягає суть утворення в природних умовах кислотних дощів.
Складіть самостійно рівняння реакцій взаємодії фосфор(V) оксиду з водою з утворенням метафосфатної та ортофосфатної кислот. Укажіть умови перебігу реакцій.
Крім того, деякі кислоти добувають під час взаємодії солей із сильними кислотами. Наприклад, якщо до натрій силікату долити сульфатну кислоту, випадає осад — силікатна кислота. Рівняння реакції:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓.
Значення кислот. Найширшого застосування в промисловому виробництві України набули хлоридна, сульфатна, нітратна й ортофосфатна кислоти, а також деякі органічні кислоти.
Серед неорганічних кислот лідерами є хлоридна й сульфатна кислоти, які належать до найважливішої продукції хімічної промисловості. Це виробництво лаків і фарб, вибухових речовин, синтетичних пластмас і волокон, мінеральних добрив, барвників, лікувальних препаратів. Також сульфатну кислоту використовують для очищення нафтопродуктів. Нітратну кислоту застосовують у великій кількості для виробництва нітроцелюлози, вибухових речовин, ліків, нітратних добрив. Ортофосфатну — як каталізатор багатьох процесів, консервант у напоях, для виготовлення полірувальних матеріалів тощо.
Багато кислот входять до складу овочів і фруктів, разом з іншими речовинами вони сприяють перетравлюванню їжі в організмі. Це насамперед органічні кислоти: молочна, яблучна, лимонна, щавлева, аскорбінова та ін. Організм людини виробляє хлоридну кислоту, яка міститься в шлунковому соці й сприяє процесу травлення. Серед неорганічних кислот важливе значення має борна. Вона входить до складу антибактеріальних та антипаразитичних засобів. У медицині її використовують для виготовлення мазі. Метанова кислота є компонентом препаратів, призначених для розширення судин, лікування грибкових захворювань, артритів, набряків.
З етанової кислоти добувають аспірин, триацетилцелюлозу, барвники. Ця речовина є незамінним консервантом у побуті, харчовою добавкою, розчиняє накип у чайниках, виводить деякі плями, зм'якшує воду.
Зверніть увагу! Треба пам'ятати, що кислоти можуть завдавати шкоди. Тому, користуючись ними, потрібно дотримуватися правил безпеки.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Кислоти — складні речовини, молекули яких містять атоми Гідрогену й кислотні залишки.
• Кислоти класифікують за кількістю атомів Гідрогену — на одноосновні, двоосновні й триосновні; за вмістом Оксигену — на оксигеновмісні й безоксигенові.
• Розчинам кислот властиві хімічні реакції з металами, основними оксидами, основами (розчинними та нерозчинними у воді), солями. Вони змінюють забарвлення індикаторів.
• З розчинами кислот реагують метали, що в ряді активності металів стоять до водню.
• Безоксигенові кислоти добувають розчиненням у воді летких сполук неметалічних елементів з Гідрогеном.
• Оксигеновмісні кислоти добувають взаємодією кислотних оксидів з водою та дією на солі сильними кислотами.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Сформулюйте визначення поняття «кислоти» та класифікуйте їх за вмістом Гідрогену й Оксигену.
- 2. Назвіть за сучасною номенклатурою відомі вам кислоти.
- 3. Укажіть, якого забарвлення набуває лакмус у розчинах кислот.
А не змінюється
Б червоного
В оранжевого
Г синього
- 4. Позначте два метали, що реагують з хлоридною кислотою.
А Hg
Б Mg
В Pt
Г Al
- 5. Установіть відповідність між реагентами та продуктами реакцій.
А Zn + H2SO4 →
Б H2SO4 + CaO →
В Na2S + H2SO4 →
Г NaOH + H2SO4 →
1 CaSO4+ H2O
2 NaHSO4+ H2O
3 Na2SO4+ 2H2O
4 ZnSO4 + Η2↑
5 Na2SO4 + H2S↑
- 6. Установіть відповідність між реагентами та продуктами реакцій, укажіть суму коефіцієнтів у кожному рівнянні.
А Fe(OH)3 + HCl →
Б Al + H2SO4 →
В Cr2O3 + HNO3 →
1 Cr(NO3)3 + H2O
2 FeCl3 + H2O
3 Al2(SO4)3 + H2
I 12
II 9
III 8
- 7. Установіть послідовність перетворень за схемами реакцій.
А H2SO4 + NaOH → Na2SO4 + H2O
Б SO2 + O2 → SO3
В SO3 + H2O → H2SO4
Г Na2SO4 + BaCl2 → BaSO4↓ + NaCl
- 8. Обчисліть і позначте об'єм гідроген сульфіду (н. у.), що виділиться внаслідок взаємодії натрій сульфіду масою 15,6 г з розчином нітратної кислоти.
А 4,48 л
Б 3,36 л
В 1,12 л
Г 2,24 л
- 9. Обчисліть і позначте маси реагентів, якщо під час реакції алюміній гідроксиду з хлоридною кислотою утворився алюміній хлорид кількістю речовини 0,4 моль.
А 30,2 г Al(OH)3 та 40,8 г HCl
Б 31,2 г Al(OH)3 та 43,8 г HCl
В 32,2 г Al(OH)3 та 44,8 г HCl
Г 32,8 г Al(OH)3 та 41,8 г HCl
Коментарі (0)