Загальна характеристика металів. Фізичні властивості металів на основі їхньої будови
- 16-11-2023, 14:07
- 455
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 25. ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ. ФІЗИЧНІ ВЛАСТИВОСТІ МЕТАЛІВ НА ОСНОВІ ЇХНЬОЇ БУДОВИ
Опанувавши матеріал параграфа, ви зможете:
- називати найпоширеніші в природі металічні елементи;
- пояснювати розміщення металічних елементів у періодичній системі; особливості будови металічних елементів;
- характеризувати метали, їхні фізичні властивості; кристалічні ґратки металів;
- порівнювати фізичні властивості металічних і неметалічних елементів.
Розміщення металічних елементів у періодичній системі. Вам уже відомо, що металічних елементів значно більше, ніж неметалічних. Вони починають кожний період (крім першого) періодичної системи, утворюють парні ряди великих періодів і головні підгрупи І—ІІІ груп. Продемонструємо їхнє розміщення на моделі періодичної системи хімічних елементів (табл. 16).
Таблиця 16
Розміщення металічних елементів у періодичній системі
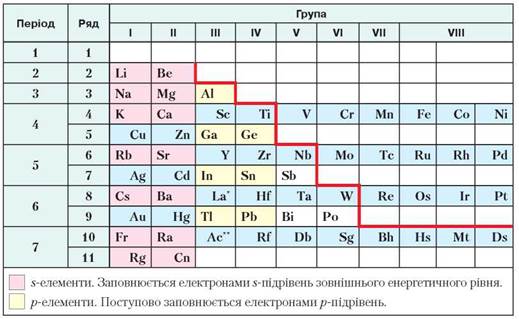
До металічних елементів належать усі d- та f-елементи.
Особливості будови атомів металічних елементів. Порівнюючи будову зовнішнього енергетичного рівня атомів металічних і неметалічних елементів, неважко зрозуміти, що атоми металічних елементів на зовнішньому енергетичному рівні мають невелику кількість електронів (1-3), крім Стануму, Плюмбуму, Бісмуту й Полонію.
Зважаючи на це, атоми металічних елементів під час хімічних реакцій віддають електрони, перетворюючись на позитивно заряджені йони — катіони.
Наприклад, відобразимо будову атома Кальцію за допомогою електронної формули: 1s22s22p63s23p64s2. Як бачимо, атом Кальцію на зовнішньому (четвертому) енергетичному рівні має два s-електрони. Віддаючи їх, атом перетворюється на йон Кальцію. Цей процес можна записати так:
[1s22s22p63s23p64s2] - 2е → [1s22s22p63s23p6]2+, або Са0 - 2е → Са2+.
Металічні елементи, на противагу неметалічним, не утворюють летких сполук з Гідрогеном. Однак лужні й лужноземельні елементи мають здатність утворювати гідриди (кристалічні речовини складу NaH, CaH2).
Прості речовини. Прості речовини металічних елементів називають металами. Їм властивий особливий вид хімічного зв'язку — металічний та металічні кристалічні ґратки (див. § 7).
Металічний зв'язок виникає під час взаємодії вільних електронів з позитивно зарядженими йонами металічних елементів, що розміщуються у вузлах кристалічних ґраток. Ці йони утворюються внаслідок втрати атомами електронів. Втрачені електрони вільно переміщуються в масі металічного тіла й належать не одному, а всім атомам. Їх називають електронним газом, або усуспільненими електронами. Електрони, наближаючись до йона, іноді до нього приєднуються, перетворюючись на атоми (рис. 42).
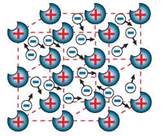
Рис. 42. Схема утворення металічного зв'язку
Метали утворюють металічні кристалічні ґратки. Розрізняють кубічні гранецентровані (рис. 43, а), об'ємноцентровані (рис. 43, б) і гексагональні (рис. 43, в) кристалічні ґратки металів. Кубічні гранецентровані кристалічні ґратки властиві залізу, натрію та іншим лужним металам, барію; кубічні об'ємноцентровані — міді, алюмінію, сріблу й золоту, а гексагональні — магнію, цинку, берилію та хрому.
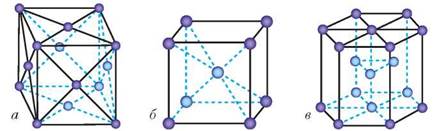
Рис. 43. Моделі кристалічних ґраток металів: а — кубічні гранецентровані; б — кубічні об'ємноцентровані; в — гексагональні
Фізичні властивості металів. Усім металам притаманні подібні фізичні властивості. Вони електро- й теплопровідні, пластичні, мають металічний блиск. Ці фізичні властивості залежать від їхньої кристалічної будови, зокрема наявності вільних електронів, що безперервно рухаються. Однак, залежно від розмірів атомів та йонів і кількості електронів, електро- й теплопровідності металів є різними. Найбільш електропровідні — срібло, мідь та алюміній. Ці ж метали найкраще проводять тепло.
Металічний блиск з'являється внаслідок здатності металів відбивати світло. Пластичність зумовлена наявністю у вузлах кристалічних ґраток однойменно заряджених йонів. Під дією на метал сили йони зміщуються, а рух електронів унеможливлює їхній відрив від маси металічного тіла.
Густина й температури плавлення металів є дуже різними й варіюють у широкому діапазоні цих показників. Метали, густина яких не перевищує 5 г/см3, називають легкими. Це алюміній та лужні метали. Важкими є ті, густина яких більша за 5 г/см3. До них належать залізо, ртуть, свинець, олово й інші.
Легкоплавкими вважають метали, температури плавлення яких не перевищують 350 °С. Це натрій, калій та цезій. До тугоплавких належать метали з температурами плавлення понад 350 °С. Лідером серед них є вольфрам.
Усі метали за звичайних умов — тверді речовини (крім ртуті).
Поширення металічних елементів у природі. Метали, які в ряді активності розміщені до водню, є хімічно активними речовинами. Вони легко реагують з киснем повітря, тому у вільному стані в природі не трапляються. В основному їх містять у своєму складі оксиди й солі. У вільному стані незначні поклади утворюють мідь, срібло, золото.
Про поширення інших металічних елементів у природі ви дізнаєтеся, ознайомившись з діаграмою (рис. 44).
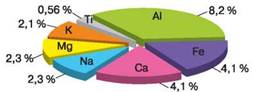
Рис. 44. Діаграма поширення металічних елементів у природі
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Металічних елементів значно більше, ніж неметалічних. Вони починають кожний період (крім першого) періодичної системи, утворюють парні ряди великих періодів і головні підгрупи І—ІІІ груп.
• В атомах металічних елементів на зовнішньому енергетичному рівні є невелика кількість електронів (1-3), за винятком Стануму, Плюмбуму, Бісмуту й Полонію.
• Атоми металічних елементів під час хімічних реакцій віддають електрони, перетворюючись на позитивно заряджені йони — катіони.
• Прості речовини металічних елементів називають металами. Їм властивий особливий вид хімічного зв'язку — металічний та атомна кристалічна будова.
• Метали утворюють металічні кристалічні ґратки: кубічні гранецентровані, кубічні об'ємноцентровані й гексагональні.
• Фізичні властивості металів залежать від їхньої кристалічної будови. Вони електро- й теплопровідні, пластичні, мають металічний блиск.
• Метали, густина яких менша від 5 г/см3, називають легкими, а ті, густина яких більша за 5 г/см3, — важкими.
• За температурами плавлення метали поділяють на легко- й тугоплавкі.
• У вільному стані в природі не трапляються, їх містять у своєму складі оксиди й солі. У вільному стані є поклади міді, срібла, золота.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Поясніть розміщення металічних елементів у періодичній системі.
- 2. Поясніть, чому металічні елементи віддають електрони під час хімічних реакцій.
- 3. Охарактеризуйте принцип утворення металічного зв'язку.
- 4. Охарактеризуйте фізичні властивості металів на основі їхньої кристалічної будови.
- 5. Складіть рівняння реакцій за схемою: К → КОН → K2SO4 → BaSO4.
- 6. Складіть рівняння реакцій за схемами: а) барій барій оксид барій гідроксид барій сульфат; б) Mg → MgO → MgCl2 → Mg(OH)2.
- 7. Купрум(ІІ) оксид масою 1,6 г прореагував з хлоридною кислотою, що містить кислоту масою 1,5 г. Обчисліть масу утвореного купрум(ІІ) хлориду.
- 8. Цинк масою 7 г вступив у реакцію із сульфатною кислотою масою 9,8 г. Обчисліть масу цинк сульфату й об'єм водню (н. у.), що утворилися.
- 9. Барій оксид масою 4,59 г прореагував з нітратною кислотою масою 4,6 г. Обчисліть масу й кількість речовини утвореної солі. Назвіть продукти реакції.
Коментарі (0)