Залізо: фізичні та хімічні властивості
- 16-11-2023, 14:10
- 459
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 27. ЗАЛІЗО: ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
Опанувавши матеріал параграфа, ви зможете:
- характеризувати залізо як просту речовину, його фізичні та хімічні властивості як представника металів;
- складати рівняння реакцій, що підтверджують відновні властивості заліза (реакції з неметалами, водою, кислотами й солями в розчинах);
- досліджувати хімічні властивості заліза та його відновні властивості;
- спостерігати демонстраційні досліди, що характеризують хімічні властивості заліза; якісні реакції на катіони Ферум(2+) і Ферум(3+);
- проводити якісні реакції та визначати в розчинах йони Феруму(2+) і Феруму(3+), осаджуючи їх лугами;
- передбачати результати лабораторних досліджень;
- робити висновки про фізичні та хімічні властивості заліза; якісні реакції на катіони Ферум(2+) і Ферум(3+); значення заліза в житті людини.
Охарактеризуйте хімічний елемент Ферум за розміщенням у періодичній системі та будовою атома.
Фізичні властивості. Елемент Ферум утворює просту речовину — залізо. Це сріблясто-білий метал, що має сіруватий відтінок. Належить до важких металів (густина 7,87 г/см3). Залізо — тугоплавкий метал з температурою плавлення 1539 °С, водночас дуже пластичний та ковкий; електро- й теплопровідний, легко намагнічується. Магнітні властивості проявляють і сплави заліза.
Пригадайте з курсу природознавства, як розділити порошки заліза й сірки.
Хімічні властивості. Залізо є досить активним металом і за певних умов реагує з неметалами, водою, кислотами й солями в розчині. З'ясуємо, як відбувається кожна з цих реакцій.
Взаємодія з неметалами. Насамперед звернемо увагу на взаємодію заліза з киснем. Цю реакцію можна спостерігати, провівши демонстраційний дослід.
Дослід 1. Прив'яжемо до сталевого леза запалений сірник та опустимо його в колбу, наповнену киснем. Метал яскраво згоряє, розбризкуючи в усі боки іскри. Це утворений унаслідок згоряння ферум(ІІ, ІІІ) оксид, тривіальна назва якого — залізна окалина (рис. 48, а). Рівняння реакції:
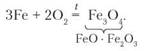
Залізо згоряє в хлорі з утворенням ферум(ІІІ) хлориду (рис. 48, б). Рівняння реакції:
![]()

Рис. 48. Горіння заліза: а — у кисні; б — у хлорі
Складіть самостійно рівняння взаємодії заліза із сіркою.
Взаємодія з водою. Залізо реагує з водою за високих температур і за звичайних умов. Залежно від умов результат реакції неоднаковий. Якщо крізь розжарений порошок заліза пропустити водяну пару, то утвориться ферум(ІІ, ІІІ) оксид і виділиться водень:
![]()
За звичайних умов реакція відбувається за участю кисню:
![]()
Взаємодія з кислотами. Щоб з'ясувати, як залізо взаємодіє з кислотами, проведемо демонстраційні досліди.
Дослід 2. Насиплемо на дно двох пробірок порошок заліза. Доллємо до першої пробірки 1,5-2 мл хлоридної кислоти, до другої — таку саму кількість розведеної сульфатної кислоти. В обох пробірках на залізі з'являються бульбашки газу. Реакції пришвидшаться, якщо пробірки з реагентами нагріємо. Запишемо відповідні рівняння реакцій:
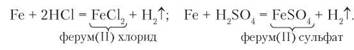
Отже, залізо реагує з хлоридною та розведеною сульфатною кислотами з утворенням солей відповідних кислот і виділенням водню.
Зверніть увагу! Йони Гідрогену є слабшими окисниками, ніж хлор, оскільки Гідроген окиснює залізо до ступеня окиснення +2, а хлор — до ступеня окиснення +3.
Дослід 3. Насиплемо на дно двох пробірок порошок заліза. Доллємо до першої пробірки 1,5-2 мл концентрованої сульфатної кислоти, до другої — таку саму кількість концентрованої нітратної. Жодних змін не спостерігаємо.
Отже, за звичайних температур залізо пасивується цими концентрованими кислотами. Це пояснюється тим, що на його поверхні утворюється захисна плівка ферум(ІІІ) оксиду, яка не вступає в реакцію з кислотою й захищає залізо від взаємодії з нею.
Взаємодія із солями в розчині. Як і алюміній, залізо реагує з розчинами солей, коли метал, що входить до складу солі, є менш активним порівняно з ним. Наприклад, за взаємодії заліза з розчином купрум(ІІ) хлориду:
Fe + CuCl2 = FeCl2 + Cu.
Розгляньте реакції взаємодії заліза з розчинами кислот і солей як окисно-відновні процеси. Поясніть, окисником чи відновником є в них залізо.
Якісне визначення катіонів ферум(2+) і ферум(3+) у розчині. Ознайомимося з якісними реакціями на прикладі демонстраційних і лабораторних дослідів.
Дослід 4. Наллємо у дві пробірки розчини ферум(ІІ) і ферум(ІІІ) сульфатів об'ємом 1,5-2 мл і доллємо до кожної з них такий самий об'єм розчину натрій гідроксиду. Спостерігаючи результати реакцій, бачимо, що в пробірці з ферум(ІІ) сульфатом випав зеленувато-білий осад, який швидко набув бурого забарвлення. У другій пробірці, де містився ферум(ІІІ) сульфат, випав бурий осад.
За кольором осадів визначаємо наявність у розчинах катіонів Ферум(2+) і Ферум(3+).
Отже, реактивом на катіони Ферум(2+) і Ферум(3+) є гідроксид-аніони. Рівняння реакцій:
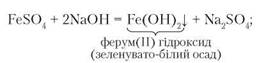
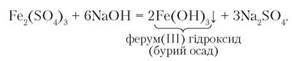
Тепер проведемо лабораторні досліди 3-4.
Лабораторні досліди 3-4. Виявлення в розчині катіонів Феруму(2+) і Феруму(3+)
Повторіть правила безпеки під час роботи з реактивами й обладнанням і суворо дотримуйтеся їх.
Завдання. Дослідіть, як виявити катіони Ферум(2+) і Ферум(3+) у розчині.
Обладнання та реактиви: дві пробірки, екран, розчини ферум(ІІ) хлориду та ферум(ІІІ) нітрату, натрій гідроксиду.
Дослід 1. Налийте в пробірку розчин ферум(ІІ) хлориду об'ємом 1,5-2 мл і додайте такий самий об'єм розчину натрій гідроксиду. Спостерігайте утворення осаду. Зверніть увагу на колір осаду та зміну його забарвлення через деякий проміжок часу. Складіть рівняння реакцій, зробіть висновок.
Дослід 2. Налийте в пробірку розчин ферум(ІІІ) нітрату об'ємом 1,5-2 мл і додайте такий самий об'єм розчину натрій гідроксиду. Спостерігайте утворення осаду. Зверніть увагу на колір осаду. Складіть рівняння реакції, зробіть висновок.
Оформте результати досліджень у зошиті як таблицю. Сформулюйте загальний висновок.
Біологічне значення Феруму. Мікроелемент Ферум відіграє вагому роль в організмі людини та відповідає за важливі життєві функції. Передусім — це елемент, що входить до складу гемоглобіну крові, надаючи їй червоного забарвлення. Він міститься і в еритроцитах, що беруть участь у транспортуванні кисню від легенів до тканин органів і виведенні вуглекислого газу. Ферум підтримує працездатність м'язів і сприяє витривалості, захищає організм від хвороботворних мікроорганізмів і вірусів. Цей елемент активно виводить токсини й шлаки.
Важливу роль відіграє Ферум в обміні речовин та енергії, зокрема входить до складу білків і ферментів, бере участь у синтезі ДНК, обміні холестерину, гормонів щитоподібної залози, впливає на роботу нервової системи.
Основна частка цього мікроелемента міститься в крові (приблизно 60 %), у печінці, селезінці, м'язах і кістковому мозку — 20 %. Решта використовується для синтезу ферментів. Загальна маса цього мікроелемента в організмі — 4-5 г.
Добова потреба організму людини у Ферумі становить 10-20 мг, значно зростаючи при інтенсивних м'язових навантаженнях. Ця кількість мікроелемента має потрапити в організм з їжею, тому надзвичайно важливим для кожної людини є збалансоване харчування.
Довідайтеся самостійно з інтернет-джерел, які продукти харчування лікарі радять уживати для підтримання вмісту Феруму в організмі людини.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Залізо — сріблясто-білий метал, що має сіруватий відтінок, важкий (густина 7,87 г/см3), тугоплавкий, пластичний, ковкий, електро- й теплопровідний, легко намагнічується.
• Залізо є достатньо активним металом і за певних умов реагує з неметалами, водою, кислотами, солями в розчині.
• Взаємодіє з неметалами за нагрівання, утворюючи бінарні сполуки. Продуктами взаємодії розжареного порошку заліза з водяною парою є залізна окалина й водень, а за звичайних умов (за наявності кисню) — ферум(ІІІ) гідроксид.
• Залізо реагує з хлоридною та розведеною сульфатною кислотами за нагрівання з утворенням солей Ферум(2+) і виділенням водню.
• За звичайних умов залізо з концентрованими сульфатною та нітратною кислотами не реагує, пасивується.
• Якісними реакціями на катіони Ферум(2+) і Ферум(3+) є взаємодія сполук, що містять ці катіони, з розчинами лугів. За взаємодії сполук, що містять катіони Ферум(2+), з лугами в осад випадає ферум(ІІ) гідроксид зеленувато-білого кольору, який на повітрі набуває бурого забарвлення. Під час реакції сполук Ферум(3+) з лугами випадає бурий осад ферум(ІІІ) гідроксид.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Охарактеризуйте: а) елемент Ферум за розміщенням у періодичній системі та будовою атома; б) фізичні та хімічні властивості заліза.
- 2. Складіть рівняння реакцій за наведеною схемою. Укажіть умови перебігу реакцій, назвіть утворені речовини.
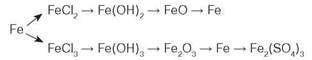
- 3. Позначте агрегатний стан заліза за звичайних умов.
А твердий
Б рідкий
В газоподібний
Г плазма
- 4. Позначте дві фізичні властивості заліза.
А крихкість
Б пластичність
В електропровідність
Г нетеплопровідність
- 5. Установіть відповідність між лівими та правими частинами рівнянь реакцій, поданих за допомогою схем.

- 6. Позначте речовини 1, 2, 3 у ланцюгу перетворень:
![]()
А KOH
Б HCl
В HNO3
Г Cl2
- 7. Позначте речовини 1, 2, 3, 4 у ланцюгу перетворень:
![]()
А FeSO4
Б FeCl2
В Fe
Г Fe(OH)2
- 8. Позначте назву речовини, що є реактивом на катіони Fe(2+) і Fe(3+).
А натрій сульфат
Б натрій гідроксид
В натрій хлорид
Г натрій сульфід
- 9. Обчисліть і позначте масу заліза, що прореагувало з хлоридною кислотою, якщо утворилася сіль кількістю речовини 0,3 моль.
А 18,8 г
Б 16,6 г
В 17,6 г
Г 16,8 г
- 10. Обчисліть і позначте кількість речовини ртуті, що виділиться внаслідок взаємодії меркурій(ІІ) нітрату із залізом масою 22,4 г.
А 0,35 моль
Б 0,4 моль
В 0,45 моль
Г 0,3 моль
- 11. Обчисліть і позначте масу осаду, що утвориться внаслідок взаємодії ферум(ІІ) броміду масою 75,6 г з розчином барій гідроксиду.
А 33,5 г
Б 32,5 г
В 30,5 г
Г 31,5 г
Коментарі (0)