Середні солі
- 16-11-2023, 14:12
- 377
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 31. СЕРЕДНІ СОЛІ
Опанувавши матеріал параграфа, ви зможете:
- називати середні солі;
- характеризувати фізичні та хімічні властивості середніх солей; поширення солей у природі;
- складати рівняння реакцій, які характеризують хімічні властивості середніх солей;
- досліджувати якісний склад солей.
Склад солей. Солі утворюють клас неорганічних речовин, склад яких розглядають як похідні кислот, у молекулах яких один або декілька атомів Гідрогену заміщуються на йони металічних елементів. Залежно від того, повністю або частково заміщуються атоми Гідрогену, розрізняють середні та кислі солі.
Середні солі — це продукти повного заміщення атомів Гідрогену в молекулі кислоти на катіони металічних елементів. Наприклад, NaNO3, K2SO4, Na3PO4.
Назви солей. Звернемося до схеми на рис. 53 і з'ясуємо, як утворюються назви середніх солей.

Рис. 53. Схема утворення назв середніх солей
Назвіть самостійно середні солі, подані формулами в тексті.
Фізичні властивості. Солі — кристалічні речовини з йонними кристалічними ґратками. За розчинністю у воді їх поділяють на розчинні (NaCl, KNO3, Al2(SO4)3), малорозчинні (CaSO4, PbCl2) і нерозчинні (AgCl, BaSO4), що можна визначити за таблицею розчинності (див. додаток 1). Солям властиві високі температури плавлення та кипіння, різне забарвлення. Наприклад, мідний купорос у розчині має синій колір, а безводна сіль купрум(ІІ) сульфат — білий. Характерне оранжеве забарвлення притаманне біхроматам, жовте — солям Феруму(3+). Більшість з них не мають запаху.
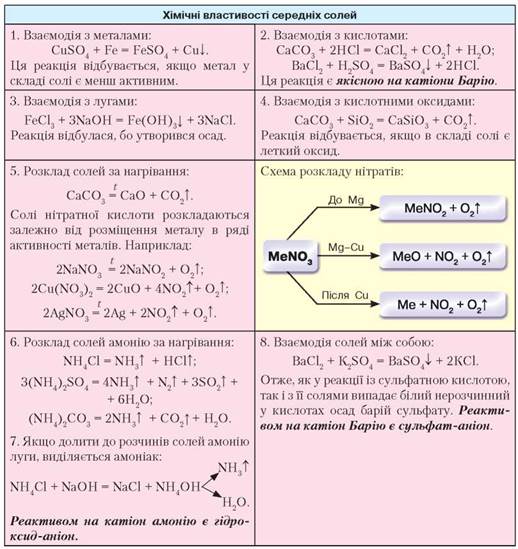
Хімічні властивості. Солі — складні речовини, що вступають у хімічну взаємодію з простими та складними речовинами. З деякими властивостями цих сполук ви вже ознайомлені, зокрема із взаємодією з металами, лугами й кислотними оксидами. Розглянемо загальні властивості середніх солей (табл. 17).
Таблиця 17
Хімічні властивості середніх солей
Лабораторний дослід 5. Виявлення в розчині катіонів Барію
Завдання. Дослідіть, як виявити катіони Барію в розчині.
Обладнання та реактиви: чотири пробірки, чорний екран, розчини барій хлориду й барій нітрату, сульфатної кислоти, натрій сульфату, нітратної кислоти.
Увага! Повторіть правила безпеки під час роботи з реактивами й обладнанням і суворо дотримуйтеся їх.
Дослід 1. Налийте у дві пробірки почергово розчини барій хлориду та барій нітрату об'ємом по 1,5-2 мл і додайте такий самий об'єм розчину сульфатної кислоти. Спостерігайте утворення осаду. Зверніть увагу на колір осаду. Долийте до утвореного осаду розчин нітратної кислоти. Опишіть спостереження. Складіть рівняння реакцій, зробіть висновок.
Дослід 2. Налийте у дві пробірки почергово розчини барій хлориду та барій нітрату об'ємом по 1,5-2 мл і додайте такий самий об'єм розчину натрій сульфату. Спостерігайте утворення осаду. Зверніть увагу на колір осаду. До утвореного осаду долийте розчин нітратної кислоти. Опишіть спостереження. Складіть рівняння реакцій, зробіть висновок.
Оформте результати досліджень у зошиті як таблицю. Сформулюйте загальний висновок.
Лабораторний дослід 6. Виявлення в розчині катіонів амонію
Завдання. Дослідіть, як виявити катіони амонію в розчині.
Обладнання та реактиви: дві пробірки, розчини амоній хлориду, амоній сульфату, натрій гідроксиду, калій гідроксиду, фенолфталеїну, смужка лакмусового паперу, вода, вата.
Увага! Повторіть правила безпеки під час роботи з реактивами й обладнанням і суворо дотримуйтеся їх.
Дослід 1. Налийте в пробірку розчин амоній хлориду об'ємом 1,5-2 мл і додайте такий самий об'єм розчину натрій гідроксиду. Піднесіть до отвору пробірки вологий фенолфталеїновий папірець. Спостерігайте зміну забарвлення фенолфталеїну. Опишіть спостереження. Складіть рівняння реакцій, зробіть висновок.
Дослід 2. Налийте в пробірку розчин амоній сульфату об'ємом 1,5-2 мл і додайте такий самий об'єм розчину калій гідроксиду. Піднесіть до отвору пробірки смужку лакмусового паперу. Спостерігайте зміну його забарвлення. Опишіть спостереження. Складіть рівняння реакцій, зробіть висновок.
Оформте результати досліджень у зошиті як таблицю. Сформулюйте загальний висновок.
Отже, середні солі — це клас неорганічних речовин, що є похідними кислот, у молекулах яких усі атоми Гідрогену заміщені на катіони металічних елементів.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Середні солі — це продукти заміщення всіх атомів Гідрогену в молекулі кислоти на катіони металічних елементів.
• Назви середніх солей походять від назви катіона металічного елемента з додаванням назви кислотного залишку.
• Солі — кристалічні речовини з високими температурами плавлення та кипіння, мають різне забарвлення, більшість без запаху. За розчинністю у воді їх поділяють на розчинні, малорозчинні й нерозчинні.
• Середні солі взаємодіють з металами, кислотами, лугами, кислотними оксидами й між собою. Розкладаються за нагрівання.
• Солі барію в розчинах визначають за допомогою сульфат-аніонів. Отже, реактивом на катіон Барію Ba2+ є сульфат-аніон SO2-4.
• Солі амонію в розчинах виявляють за допомогою гідроксид-аніонів. Отже, реактивом на катіони амонію NH+4 є гідроксид-аніони OH-.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Поясніть склад і назви солей.
- 2. Назвіть солі за їхніми формулами: BaCl2, Fe(NO3)3, Al2(SO4)3, KF, ZnS, Li2SO4, Na3PO4, MgBr2.
- 3. Охарактеризуйте хімічні властивості середніх солей.
- 4. Допишіть праві частини рівнянь реакцій, доберіть коефіцієнти:
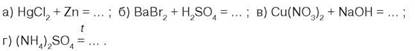
- 5. Складіть рівняння реакцій за схемами:
а) Са → СаО → Са(ОН)2 → СаСО3 → СО2 → Na2CO3 → NaCl;
б) Н2 → NH3 → NH4Cl → NH4OH → (NH4)2SO4 → SO2 → K2SO3.
- 6. Кальцій карбонат масою 12,5 г з масовою часткою домішок 0,2 піддали дії хлоридної кислоти. Обчисліть об'єм газу (н. у.), що утворився.
- 7. Натрій сульфіт масою 25,2 г прореагував з надлишком хлоридної кислоти. Обчисліть масу утвореної солі й об'єм газу (н. у.), що утворилися.
- 8. У трьох пробірках під шифрами є розчини натрій хлориду, барій хлориду й амоній хлориду. Поясніть, як довести, що в усіх трьох пробірках наявні хлориди, та якими реактивами необхідно скористатися, щоб визначити кожну з цих речовин. Складіть рівняння реакцій.
Коментарі (0)