Мінеральні добрива. Поняття про кислотні та лужні ґрунти
- 16-11-2023, 14:15
- 305
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 37. МІНЕРАЛЬНІ ДОБРИВА. ПОНЯТТЯ ПРО КИСЛОТНІ ТА ЛУЖНІ ҐРУНТИ
Опанувавши матеріал параграфа, ви зможете:
- називати чинники, що впливають на забезпечення зростання обсягів виробництва продукції рослинного походження для розв'язання продовольчої проблеми;
- характеризувати значення мінеральних добрив, хімічних засобів захисту рослин і тварин, стимуляторів росту, штучних кормів для збільшення обсягів виробництва тваринної сільськогосподарської продукції;
- прогнозувати рН середовища кислотних і лужних ґрунтів;
- робити висновки про роль хімії в розв'язанні продовольчої проблеми.
Хімія та продовольча проблема. Нині однією з глобальних проблем людства є забезпеченість людини продовольством, оскільки їжа підтримує життєдіяльність організмів. Через постійне зростання населення планети виникло питання, чи зможе людство забезпечувати себе продуктами харчування в майбутньому. На думку вчених, проблему можна розв'язати, якщо виробництво харчових продуктів у світі зросте в 3-4 рази. Щоб досягти цього, необхідно модернізувати сільське господарство.
Зробити це неможливо без застосування хімічних і біологічних знань. Відомо, що для збереження здоров'я потрібно вживати їжу природного походження. Тобто насамперед треба сконцентрувати увагу на виробництві рослинної та тваринної їжі. Модернізація сільського господарства полягає у створенні таких умов, які сприяли б росту та розмноженню рослин. З'ясуємо роль хімії в розв'язанні цієї проблеми.
Завдання хімії з підвищення виробництва рослинної продукції полягає в забезпеченні сільського господарства мінеральними й органічними добривами, хімічними засобами захисту рослин і тварин, стимуляторами росту, штучними кормами й новими продуктами.
Виробництво мінеральних добрив. Для підвищення врожайності сільськогосподарських культур використовують мінеральні добрива — речовини, які містять найважливіші хімічні елементи, що впливають на ріст і розвиток рослин, збільшуючи їхню врожайність.
Передусім — це солі, що містять макро- й мікроелементи, які рослини поглинають у формі йонів. Вони утворюються внаслідок дисоціації солей, що містяться в ґрунтовому розчині. Рослини у великих кількостях використовують макроелементи, особливо Нітроген, Фосфор і Калій. Крім них, до макроелементів належать Оксиген, Карбон, Сульфур, Магній, Кальцій та Гідроген.
З'ясуємо, як Нітроген, Фосфор і Калій впливають на рослини.
Нітроген — елемент, що входить до складу молекул амінокислот і білків. Нестача його в ґрунті сповільнює утворення зеленої маси, що, відповідно, впливає на майбутній урожай. Вам відомо, що зелена маса рослин розвивається навесні. Якраз тоді потрібно вносити в ґрунт нітратні добрива — добрива, що містять Нітроген). Рослини, яким бракує Нітрогену, мають блідо-зелені, а іноді й жовті листки.
Фосфор — елемент, потрібний для росту та розвитку рослин, оскільки він є в нуклеїнових кислотах, а ті беруть участь в усіх окисно-відновних процесах рослин. Потрібний також під час цвітіння та плодоношення рослин, тобто для розвитку їхніх репродуктивних органів.
Калій — елемент, що стимулює процес фотосинтезу, а отже, сприяє утворенню глюкози, крохмалю, целюлози в клітинах рослин. Під час негоди злакові культури вилягають, що ускладнює їхній ріст і збір урожаю. Цей елемент зміцнює стебла злакових, сприяє накопиченню крохмалю в картоплі, сахарози в цукровому буряку.
Мікроелементи — елементи, яких рослини потребують мало, але вони впливають на засвоєння макроелементів. До них належать Ферум, Купрум, Цинк, Манган, Бор та ін. Наприклад, Бор і Манган сприяють кращому засвоєнню Нітрогену, Фосфору та Калію; Манган, Купрум і Цинк пришвидшують окисно-відновні процеси тощо.
Класифікацію мінеральних добрив зображено на схемі рис. 60.
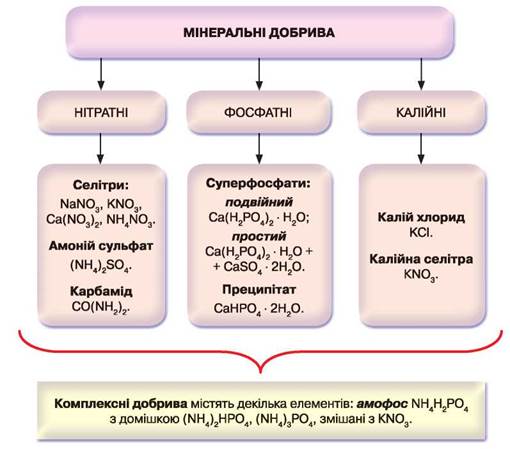
Рис. 60. Схема класифікації мінеральних добрив
Кислотні та лужні ґрунти. На розвиток коріння та ріст рослин значною мірою впливає реакція середовища ґрунту, або його рН. Найчастіше рН ґрунтів вимірюють у діапазоні від 3 до 9. Залежно від цього показника, середовище ґрунтових розчинів може бути кислотним, нейтральним або лужним.
Кислотність ґрунту визначають надмірним вмістом у ґрунтовому розчині катіонів Гідрогену Н+, pH становить менше 7. У кислотних ґрунтах розрізняють актуальну та потенційну кислотність. Під час біохімічних процесів у ґрунті утворюються органічні кислоти й вуглекислий газ, а внаслідок його взаємодії з водою — карбонатна кислота. Наявні кислоти, дисоціюючи, утворюють йони Гідрогену, які підкислюють ґрунт. Під час гідролізу солей Алюмінію та Феруму теж утворюються кислоти, здатні дисоціювати на катіони Гідрогену.
Складіть самостійно рівняння реакції гідролізу алюміній хлориду й переконайтеся в утворенні хлоридної кислоти.
Висока кислотність ґрунту негативно впливає на рослини. Щоб її нейтралізувати, застосовують вапнування ґрунту — внесення вапняку, вапняного борошна, крейди, мергелю або гашеного вапна. Нині також поширені способи використання відходів. Зокрема, для зниження кислотності ґрунту використовують відходи виробництва цукру, які містять кальцій карбонат і попіл.
Для лужних ґрунтів характерною є надмірна кількість гідроксид-аніонів у ґрунтовому розчині, рН такого ґрунту становить 7,5-8,5. Дуже лужні ґрунти вкрай погано впливають на врожайність. Крім того, погіршуються його фізичні властивості та водний режим. Зменшення вмісту гідроксид-іонів досягають гіпсуванням, тобто внесенням у ґрунт гіпсу. Під час взаємодії кальцій сульфату з катіонами Натрію утворюється натрій сульфат — сіль, яка добре розчинна у воді та легко вимивається з ґрунту.
Найкраще середовище для розвитку рослин — нейтральне, коли рН вимірюється в межах 5,5-7,5.
Щоб підтримувати високу врожайність сільськогосподарської продукції, необхідно стежити за кислотністю ґрунтів на присадибній ділянці.
Пригадайте з курсу хімії 9 класу, як виміряти рН продуктів харчування та мінеральних вод.
Звичайно, для цього можна використати лакмусовий індикатор і зіставити його зі шкалою кислотності, що продається у формі кольорових рН-смужок. Однак такий спосіб визначення кислотності складний та не завжди точний. Він вимагає виготовлення ґрунтового розчину, незіпсованого індикатора та сприйняття кольору людиною.
Є біологічний спосіб визначення кислотності за допомогою рослин-індикаторів (рис. 61). Наприклад, на кислотних ґрунтах добре ростуть подорожник, хвощ польовий, калюжниця болотна, яглиця, щавель кінський; на нейтральних — пирій повзучий, конюшина, кропива, осот польовий, мати-й-мачуха; лужні ґрунти покриваються червоними маками, гірчицею, живокостом, молочаєм тощо. Знову ж таки, чекаючи, коли зацвітуть на ділянці ці рослини-бур'яни, можна втратити частину врожаю.
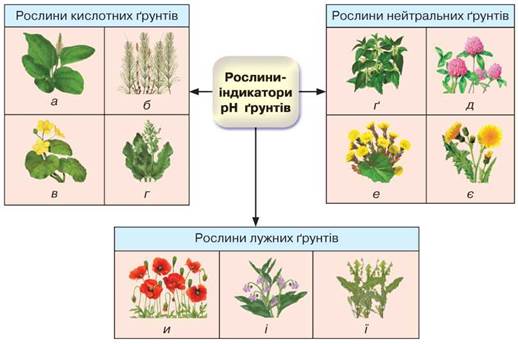
Рис. 61. Рослини-індикатори кислотності ґрунту: а — подорожник; б — хвощ польовий; в — калюжниця; г — щавель кінський; ґ — кропива; д — конюшина; е — мати-й-мачуха; є — осот польовий; и — мак; і — живокіст; ї — молочай
Нині є надійні засоби для вимірювання кислотності як у лабораторіях, так і для домашнього користування. Це рН-тестери, за допомогою яких швидко та професійно можна визначити кислотність ґрунту на присадибній ділянці чи грядці, штучно створеній на підвіконні.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Мінеральні добрива — це речовини, які містять найважливіші хімічні елементи, що впливають на ріст і розвиток рослин, збільшуючи їхню врожайність.
• Нітроген, Фосфор і Калій — макроелементи, які рослини використовують у великих кількостях.
• До мікроелементів належать елементи, які рослини використовують в малих дозах, але вони впливають на засвоєння рослиною макроелементів. Це Ферум, Купрум, Цинк, Манган, Бор та ін.
• Нітратні добрива, або селітри, містять у своєму складі Нітроген: NaNO3, KNO3, Ca(NO3)2, NH4NO3. Впливають на розвиток зеленої маси рослин.
• Фосфатні добрива містять елемент, необхідний під час росту та розвитку рослин. Це суперфосфати: подвійний Са(Н2РО4)2 і простий Са(Н2РО4)2 + СаSO4, особливо потрібний рослинам під час цвітіння та плодоносіння.
• Калійні добрива містять у своєму складі Калій, який стимулює процес фотосинтезу, сприяє накопиченню поживних речовин і забезпечує стійкість стебел до вилягання. Використовують калій хлорид KCl та калієву селітру KNO3.
• Комплексні добрива — такі, що містять декілька елементів: амофоска — NH4H2PO4 з домішкою (NH4)3PO4, (NH4)2HPO4, змішані з KNO3.
• На розвиток коріння та ріст рослин впливає рН ґрунтів. Залежно від цього показника, середовище ґрунтових розчинів може бути кислотним, нейтральним або лужним.
• Кислотність ґрунту визначають надмірним вмістом у ґрунтовому розчині катіонів Гідрогену Н+ унаслідок утворення органічних і неорганічних кислот і вуглекислого газу під час біохімічних процесів у ґрунті.
• Нейтралізують кислотні ґрунти вапняком, вапняним борошном, крейдою, мергелем, гашеним вапном, відходами виробництва цукру, попелом.
• Лужні ґрунти характеризує надмірна кількість гідроксид-аніонів у ґрунтовому розчині, pH становить 7,5-8,5. Нейтралізують гіпсуванням.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Охарактеризуйте мінеральні добрива: а) нітратні; б) фосфатні; в) калійні.
- 2. Поясніть вплив мінеральних добрив на ріст і розвиток рослин.
- 3. Натрій нітрат, який використовують як нітратне добриво, може не тільки бути корисним, а й завдавати шкоди. Висловте своє судження щодо користі та шкоди цієї речовини. Підтвердьте відповідь рівняннями реакцій, де можливо.
- 4. Установіть відповідність між формулами та назвами добрив.
А Са(Н2РО4)2 · H2O
Б (NH4)2SO4
В KNO3
Г CO(NH2)2
1 калієва селітра
2 карбамід
3 подвійний суперфосфат
4 простий суперфосфат
5 амоній сульфат
- 5. Обчисліть масову частку Нітрогену в амоній сульфаті.
- 6. Натрій ортофосфат кількістю речовини 0,4 моль повністю прореагував з кальцій хлоридом. Обчисліть маси продуктів реакції.
- 7. Нітратна кислота масою 126 кг прореагувала з амоніаком об'ємом 60 м3 (н. у.). Обчисліть масу утвореного амоній нітрату.
- 8. Вам відомо, що для росту зеленої маси рослин використовують нітратні добрива: натрієву, калієву, кальцієву й амоніачну селітри, карбамід. Обчисліть та порівняйте, яке з цих добрив економічно найвигідніше вносити в ґрунт за вмістом Нітрогену в них.
Коментарі (0)