Неметали
- 15-11-2023, 05:52
- 334
11 клас , Хімія 11 клас Попель, Крикля (рівень стандарту)
§ 15. Неметали
Матеріал параграфа допоможе вам:
- пригадати відомості про найважливіші неметали;
- дізнатися про явище алотропії;
- зрозуміти, чим можуть різнитися прості речовини хімічного елемента;
- отримати інформацію про поширеність неметалів у природі.
Неметалічні елементи утворюють прості речовини, загальна назва яких — неметали (мал. 26). Вони здебільшого відрізняються від металів за зовнішнім виглядом, фізичними властивостями, часто — агрегатним станом за звичайних умов. Ці відмінності зумовлені особливостями будови неметалів.

Мал. 26. Неметали
Будова неметалів. Частина неметалів має атомну будову. З окремих атомів складаються інертні гази — гелій, неон, аргон, криптон, ксенон і радон. У графіті, алмазі, силіції, борі, червоному фосфорі атоми сполучені один з одним.
Інші неметали — молекулярні речовини. Вам відомо, що існують неметали, які складаються із двохатомних молекул. (Назвіть ці речовини.) Більша кількість атомів міститься в молекулах озону О3, білого фосфору Р4, сірки S8.
Атоми в неметалах сполучені ковалентними неполярними зв’язками — простими, іноді подвійними, потрійними.
Алотропія. Для деяких неметалічних елементів відомо по дві або більше простих речовин.
Явище утворення елементом кількох простих речовин називають алотропією1.
1 Термін походить від грецьких слів allos — інший і tropos — місце.
Прості речовини одного елемента (їх називають алотропними модифікаціями) можуть різнитися будовою, кількістю атомів у молекулах, способом їх сполучення. Це впливає на фізичні властивості речовин, а в окремих випадках і на їх активність у хімічних реакціях.
Прості речовини Оксигену. Для Оксигену існує дві прості речовини — кисень О2 і озон О3 (мал. 27). Озон, на відміну від кисню, має запах, є отруйним; його температури плавлення і кипіння вищі, ніж кисню. Він виявляє значно більшу хімічну активність.

Мал. 27. Масштабні моделі молекул O2 і O3
Прості речовини Карбону. Загальна назва простих речовин Карбону — вуглець. Серед них є речовини атомної будови — алмаз і графіт, а також молекулярна речовина фулерен (мал. 28). Молекула фулерену складається із 60 атомів2.
2 Добуто також прості речовини, молекули яких містять 70 і більше атомів Карбону.
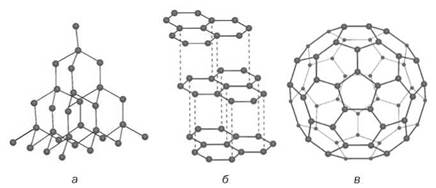
Мал. 28. Будова простих речовин Карбону: а — фрагмент кристалічних граток алмазу; б — фрагмент кристалічних граток графіту; в — модель молекули фулерену
Алмаз — безбарвна кристалічна речовина, яка не проводить електричного струму і є найтвердішою серед природних речовин. В алмазі кожний атом Карбону сполучений простими ковалентними зв’язками із чотирма іншими атомами (мал. 28, а).
Графіт — темно-сіра речовина зі слабким металевим блиском, яка проводить електричний струм. Графіт має шарувату будову (мал. 28, б). Зв’язок між атомами реалізується лише в шарі, який нагадує бджолиний стільник. Кожний атом Карбону сполучений із трьома іншими атомами простими ковалентними зв’язками за участю трьох валентних електронів. Четвертий електрон переходить від одного атома до іншого в шарі (схожість із електронною системою в молекулі бензену). Такі електрони зумовлюють електропровідність графіту. Завдяки шаруватій будові графіт досить м’який. Коли ми пишемо олівцем, шари атомів Карбону легко відокремлюються один від одного і залишаються на папері.
Молекула фулерену С60 нагадує футбольний м’яч, зшитий із 20 шестикутників і 12 п’ятикутників (мал. 28, в).
Іноді до простих речовин Карбону зараховують вугілля, хоча в ньому, крім атомів цього елемента, є ще й інші атоми. Речовину, яка майже повністю складається з атомів Карбону, можна добути нагріванням деревини за високої температури й відсутності повітря. Деревина поступово обвуглюється, а з реактора виділяються водяна пара і газоподібні речовини з неприємним запахом. Після експерименту залишається порувата речовина чорного кольору — так зване деревне вугілля. Атоми Карбону розміщені в ній хаотично; тому її називають аморфним вуглецем.
Прості речовини Сульфуру. Цей елемент утворює дві дуже схожі кристалічні прості речовини — моноклінну і ромбічну сірку. У них містяться однакові молекули S8, але порядок їх розташування у кристалах речовин різний (мал. 29).
Мал. 29. Кулестержнева модель молекули S8 (а). Будова кристалів ромбічної (б) і моноклінної (в) сірки
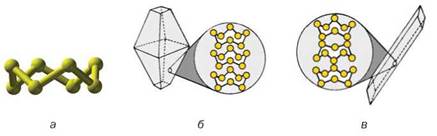
Якщо сірку розплавити, нагріти майже до кипіння, а потім вилити рідину в холодну воду, то вона застигне в масу, що нагадує пластилін. Це — пластична сірка (мал. 30), яка складається із ланцюгових молекул S4, S6 та ін. Із часом такі молекули руйнуються, формуються циклічні молекули S8, і пластична сірка поступово перетворюється на тверду й крихку ромбічну сірку.

Мал. 30. Утворення пластичної сірки
Прості речовини Фосфору. Елемент Фосфор утворює кілька простих речовин. Найважливішими є білий і червоний фосфор. Білий фосфор складається з молекул Р4, а червоний — зі сполучених між собою атомів (мал. 31). Білий фосфор, на відміну від червоного, має часниковий запах, дуже отруйний і хімічно активніший. При нагріванні на повітрі до 50 °С він займається, а за звичайних умов окиснюється з виділенням енергії у вигляді світла (тому його зберігають під водою).

Мал. 31. Прості речовини Фосфору
Поширеність неметалів у природі. Вам відомо, що азот і кисень — головні компоненти повітря. Воно містить також невеликі кількості інертних газів, серед яких найбільше аргону. У верхніх шарах атмосфери переважають найлегші гази — водень і гелій.
В атмосфері також є дуже малі кількості озону, який зосереджений у так званому озоновому шарі на висоті від 20 до 25 км. Цей газ утворюється із кисню під впливом космічної радіації або електричних розрядів (коли виникають блискавки):
3О2 = 2О3.
Оскільки молекули озону нестійкі, відбувається зворотна реакція з поглинанням частини ультрафіолетових променів сонячного світла, шкідливої для живих організмів.
Процеси утворення і розкладу озону компенсують один одного. Проте іноді озоновий шар зазнає часткового руйнування. Однією з причин цього є взаємодія озону з речовинами промислового походження. Нині здійснюються заходи, спрямовані на збереження озонового шару.
У літосфері трапляються три неметали — сірка, графіт і алмаз. В Україні є поклади сірки (у Львівській, Івано-Франківській і Тернопільській областях) і графіту (у Кіровоградській і Запорізькій областях).
• Чому, на вашу думку, в природі немає галогенів — фтору, хлору, брому, йоду?
ВИСНОВКИ
Неметали — прості речовини неметалічних елементів. Деякі неметалічні елементи утворюють по кілька простих речовин, які різняться будовою і фізичними властивостями. Таке явище називають алотропією.
Більшість неметалів має молекулярну будову, а деякі складаються з атомів.
Неметали поширені в природі. Основними компонентами повітря є азот і кисень, у літосфері трапляються сірка, графіт, алмаз.
Невелика кількість озону в атмосфері зосереджена в так званому озоновому шарі й затримує шкідливу частину ультрафіолетових променів сонячного світла.
- 107. Укажіть твердження, у яких ідеться про галогени-елементи або про галогени як прості речовини:
а) усі галогени забарвлені;
б) галогени входять до складу сполук, загальна назва яких — галогеніди;
в) галогени є активними неметалами;
г) електронегативність галогенів досить висока.
- 108. Чим різняться між собою прості речовини: а) Оксигену; б) Карбону?
- 109. Охарактеризуйте хімічний зв’язок у молекулі S2 (із таких молекул складається газувата сірка за дуже високої температури).
- 110. Які властивості графіту зумовлюють його використання на практиці? Поясніть ці властивості речовини, виходячи з її будови.
- 111. Як можна пояснити те, що білий фосфор виявляє більшу хімічну активність, ніж червоний фосфор? Чи слід чекати на аналогічну відмінність в активності ромбічної та моноклінної сірки?
- 112. Яка кількість речовини міститься: а) в 0,48 г озону; б) в 4,48 л аргону (н. у.)? (Усно.)
- 113. Масова частка озону в суміші з киснем становить 7,2 %. Обчисліть об’ємну частку озону в цій суміші.
Коментарі (0)