Солі
- 15-11-2023, 06:03
- 381
11 клас , Хімія 11 клас Попель, Крикля (рівень стандарту)
§ 27. Солі
Матеріал параграфа допоможе вам:
- розширити свої знання про солі, їх поширеність у природі;
- отримати нову інформацію про властивості солей.
Солі — один із найважливіших класів неорганічних сполук. Із цими сполуками ви докладно ознайомились у 8 класі.
Солі — це йонні сполуки, які містять катіони, утворені металічними елементами, або катіони амонію та аніони кислотних залишків.
Поширеність у природі. У літосфері трапляється багато солей. Майже всі вони нерозчинні у воді. Серед них найбільше силікатів, карбонатів (мал. 77), сульфідів, фосфатів. Кальцій карбонат входить до складу черепашок, коралів, яєчної шкаралупи.

Мал. 77. Мінерали, що є солями
У гідросфері містяться катіони металічних елементів, аніони кислотних залишків. При випаровуванні води із концентрованих природних розчинів кристалізуються розчинні солі (наприклад, натрій хлорид, калій хлорид). У давнину з таких солей утворилися різноманітні поклади.
Класифікація солей. Зважаючи на склад солей, виокремлюють три важливі типи цих сполук (схема 7):
Схема 7
Типи солей
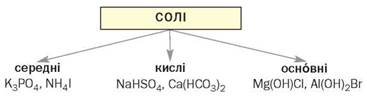
Середні солі. До солей цього типу належать сполуки із формулами NaCl, NH4F, Al2S3, Na2CO3, Ca3(PO4)2та багато інших. Загальні формули середніх солей — МnЕm, Мn(ЕОm)р.
Середню сіль часто розглядають як продукт повного заміщення атомів Гідрогену в молекулі кислоти на атоми (точніше — йони) металічного елемента або йони амонію: H2S => Na2S. Її також можна вважати продуктом повного заміщення аніонів ОН (гідроксогруп) в основі чи амфотерному гідроксиді на аніони кислотних залишків: Zn(OH)2=> Zn(NO3)2.
Назва середньої солі складається із двох слів — назви катіона (за потреби додають значення його заряду римською цифрою) і назви аніона: NaI — натрій йодид, NH4Cl — амоній хлорид, Fe2(SO4)3 — ферум(ІІІ) сульфат.
Кислі солі. Про солі цього типу йшлося в § 12; вони утворюються при гідролізі середніх солей, які містять багатозарядні аніони. Приклади формул кислих солей: NaHCO3, NH4HS, КН2РО4, К2НРО4. Кожна сполука містить аніони гідрогеновмісного кислотного залишку. Для карбонатної кислоти Н2СО3 це — йон НСО-3 (продукт 1-ї стадії дисоціації кислоти), а для ортофосфатної Н3РО4 — два йони — Н2РО-4 і НРО2-4 (продукти 1-ї та 2-ї стадій дисоціації). Отже, кисла сіль — продукт неповного заміщення атомів Гідрогену в молекулі багатоосновної кислоти на атоми (йони) металічного елемента або йони амонію.
Цікаво знати
Добре відома хімікам сіль NaNH4HPO4 містить, крім аніонів НРО2-4, катіони Na+ i NH+4.
Назва кислої солі складається із назв катіона та аніона із зазначенням кількості атомів Гідрогену в ньому (якщо їх два або більше):
К2НРО4 — калій гідрогенортофосфат;
КН2РО4 — калій дигідрогенортофосфат.
Основні солі. Вам уже відомо, що основні солі утворюються при гідролізі деяких середніх солей (§ 12). Вони походять від основ або амфотерних гідроксидів М(ОН)n (n ≥ 2): Mg(OH)Cl, Al(OH)SO4, Al(OH)2NO3. Основна сіль — продукт неповного заміщення гідроксид-іонів (гідроксильних груп) в основі або амфотерному гідроксиді на йони кислотного залишку. У солях цього типу є гідроксовмісні катіони металічних елементів. Катіон MgOH+ відповідає основі Mg(OH)2, а катіони Аl(ОН)+2 і АlОН2+ — амфотерному гідроксиду Аl(ОН)3.
Назва основної солі містить назву катіона із зазначенням кількості гідроксильних груп (якщо їх дві або більше) і назву аніона:
Mg(OH)Cl — гідроксомагній хлорид;
Fe(OH)2NO3 — дигідроксоферум(ІІІ) нітрат.
Властивості солей. Багато солей розчиняється у воді. При випарюванні їх розчинів часто виділяються кристалогідрати (мал. 78); їхній колір зумовлений кольором гідратованих катіонів.

Мал. 78. Кристалогідрати нітратів
Нерозчинними є аргентум хлорид, барій сульфат, більшість карбонатів, ортофосфатів, сульфідів тощо (форзац II). Таку властивість солей використовують для виявлення відповідних йонів у водних розчинах, тобто при проведенні якісних реакцій (§ 31). Розчинність у воді сульфатів Аргентуму, Плюмбуму, Кальцію, деяких інших солей досить мала. Кислі солі, як правило, розчиняються краще за середні.
Електролітична дисоціація і гідроліз. У водних розчинах солі дисоціюють на відповідні йони:
KNO3 = K+ + NO-3;
NaHCO3 = Na+ + HCO-3;
Al(OH)Cl2 = AlOH2+ + 2Cl-.
• Складіть рівняння електролітичної дисоціації солей Li2SO4, NaH2PO4, Fe(OH)2NO3.
Солі, утворені слабкими основами або/і слабкими кислотами, зазнають гідролізу (§ 12):
NH4NO3 + H2O ⇄ NH4OH + HNO3;
Na2S + H2O ⇄ NaHS + NaOH;
Al2S3 + 6H2O = 2Аl(ОН)3↓ + 3H2S↑.
Цікаво знати
Активні метали реагують у розплавах із деякими солями (хлоридами, фторидами). Так добувають, наприклад, уран.
Реакції з металами. Розчинені у воді солі реагують з металами. У такій реакції утворюються нові сіль і метал. Речовини взаємодіють, якщо метал-реагент активніший за очікуваний метал-продукт:
CuSO4 + Mg = MgSO4 + Cu.
Реакції з лугами, кислотами, іншими солями. Оскільки солі складаються з йонів, то вони вступають у реакції обміну. Реакція між сіллю і лугом, кислотою або іншою сіллю в розчині відбувається, якщо серед можливих продуктів — нерозчинна чи нестійка сполука, слабкий електроліт або газ. Приклади реакцій обміну за участю водорозчинних сульфатів:
FeSO4 + 2KOH = Fe(OH)2↓ + K2SO4;
CuSO4 + Na2S = CuS↓ + Na2SO4.
Із кислотами сульфати, як правило, не взаємодіють, бо сульфатна кислота є сильною й нелеткою.
• Доберіть для реакцій із натрій ортофосфатом другий реагент — луг, кислоту, сіль — і складіть три відповідні хімічні рівняння.
Кислі та основні солі можна перетворити на середні, додавши до них відповідно луг або кислоту:
NaHSO4 + NaOH = Na2SO4 + Н2О;
Zn(OH)Cl + НСl = ZnCl2 + Н2О.
Можливі й протилежні перетворення:
Na2SO4 + H2SO4 = 2NaHSO4;
ZnCl2 (надлишок) + NaOH = Zn(OH)Cl + NaCl.
Термічний розклад. Важливою є поведінка солей оксигеновмісних кислот за нагрівання. Карбонати і сульфати розкладаються на два відповідних оксиди:
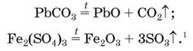
1 За високої температури сульфур(VІ) оксид розкладається:
![]()
Склад продуктів термічного розкладу нітратів залежить від перебування в ряду активності металу, від якого походить катіон солі (схема 8).
Схема 8
Термічний розклад нітратів

Приклади відповідних реакцій:
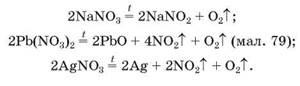

Maл. 79. Виявлення кисню тліючою скіпкою під час розкладу плюмбум нітрату
Солі лужних елементів є термостійкими (карбонати, сульфати) або зазнають специфічного розкладу:
![]()
Якщо сіль утворена твердим кислотним оксидом (наприклад, Р2О5, SiO2) або амфотерним оксидом як кислотним, то вона не розкладається при нагріванні.
Застосування. Солі, порівняно зі сполуками інших класів — оксидами, гідроксидами, кислотами, найбільше використовуються в різних сферах (схема 9).
Схема 9
Застосування солей
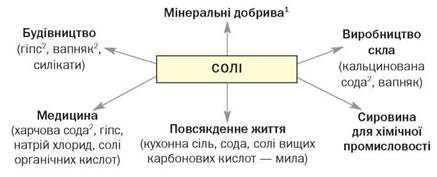
1 Докладно про ці речовини йдеться в § 30.
2 Гіпс — CaSO4 · 2Н2О, вапняк — СаСО3, кальцинована сода — Na2CO3, харчова сода — NaHCO3.
Кальцій хлорид використовують у техніці, лабораторній практиці для осушування газів і органічних розчинників; ця сіль є компонентом охолоджувальних сумішей. Купрум(ІІ) сульфат, пентагідрат, або мідний купорос CuSO4 · 5Н2О, — один із засобів проти хвороб і шкідників рослин. Нітрати Калію, Натрію й амонію застосовують у виробництві вибухових речовин, а нітрати Літію, Стронцію і Барію є складниками піротехнічних сумішей. Кислі ортофосфати Кальцію, Натрію, амонію слугують кормовими добавками у тваринництві.
ВИСНОВКИ
Солі — сполуки, які складаються з катіонів, утворених металічними елементами (або катіонів амонію), і аніонів кислотних залишків.
Розрізняють середні, кислі й основні солі. Кислі солі містять гідрогеновмісні аніони, а основні — гідроксовмісні катіони.
Солі в розчинах взаємодіють із металами, лугами, кислотами, іншими солями. Більшість солей зазнає гідролізу, а деякі розкладаються при нагріванні.
Багато солей використовують на практиці.
- 214. Чим відрізняється від середньої солі:
а) кисла сіль;
б) основна сіль?
- 215. Чи можуть утворювати кислі солі хлоридна, сульфатна, нітратна кислота? У разі позитивної відповіді запишіть формули відповідних кислих солей Калію та Кальцію.
- 216. Складіть формули кислих ортофосфатів Кальцію, основних хлоридів Хрому(ІІІ) і дайте назву кожній солі.
- 217. Напишіть рівняння реакцій магній нітрату з лугом, амоній карбонатом, сульфатною кислотою. Укажіть умови, за яких відбувається кожна реакція.
- 218. Наведіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
SO3 → MgSO4 → K2SO4 → PbSO4.
- 219. Доберіть другий реагент для того, щоб добути алюміній сульфат:
а) із солі Al(OH)SO4;
б) із солі Al(HSO4)3.
- 220. Складіть схеми термічного розкладу нітратів Літію, Феруму(ІІІ), Меркурію(ІІ) та перетворіть їх на хімічні рівняння за методом електронного балансу.
- 221. Розчин, що містив 17,1 г барій гідроксиду, змішали з розчином, у якому містилося 29,4 г ортофосфатної кислоти. Назвіть сіль, яка утворилася, та знайдіть її масу.
- 222. Обчисліть сумарний об’єм газів (у перерахунку на нормальні умови), що виділилися внаслідок повного термічного розкладу 7,4 г магній нітрату.
- 223. До кальцій гідроксиду масою 3,7 г додали розчин, що містив 8,4 г нітратної кислоти. Яка сполука не прореагувала повністю? Знайдіть масу її залишку.
- 224. Калій нітрат при нагріванні втратив 10 % своєї маси. Які речовини містяться у твердому залишку після реакції? Обчисліть їх масові частки.
- 225. Маса купрум(ІІ) ортофосфату, добутого за реакцією між мідним купоросом CuSO4 · 5Н2O і достатньою кількістю натрій ортофосфату, виявилась удвічі меншою за взяту масу мідного купоросу. Знайдіть відносний вихід купрум(ІІ) ортофосфату.
Коментарі (0)