Медико-генетичне консультування
- 19-09-2021, 16:33
- 1 185
10 Клас , Біологія і екологія 10 клас Шаламов
§ 37. Медико-генетичне консультування
Медико-генетичне консультування використовують для оцінки ризику появи спадкових порушень у нащадків
Появу спадкових хвороб, описаних у попередньому параграфі, часто можна спрогнозувати ще до народження дитини завдяки знанню генетичних закономірностей. Саме в такому прогнозуванні й полягає завдання медико-генетичного консультування.
Найчастіше до медико-генетичної консультації звертаються батьки, які мають дітей із певними генетичними вадами чи хворобами. У такому випадку мета консультування полягає в уточненні природи спадкового захворювання, оцінці ризику появи захворювання в нащадків у цій родині, допомозі у прийнятті рішення щодо народження майбутньої дитини. Також завдяки медико-генетичній консультації родина отримує поради щодо адаптації до життя з дитиною, яка має спадкове порушення, допомогу в її лікуванні й реабілітації.
Окрім таких родин, послугами медико-генетичної консультації користуються й люди, у родичів яких є генетична вада чи хвороба. Спеціалісти з медичної генетики також радять звертатися до консультації подружжям, які мають спільних родичів, оскільки у їхніх дітей зростає ризик прояву рецесивних мутацій, що в гомозиготному стані спричиняють генетичні захворювання. Варто проконсультуватися й тоді, коли вік когось з батьків більший за 35 років, позаяк значно зростає ймовірність виникнення мутацій, особливо порушень розходження хромосом. При дії на організм перед зачаттям дитини або під час вагітності умов, що можуть індукувати появу мутацій (прийом певних ліків, робота з ультрафіолетовими й рентгенівськими променями тощо), батькам також варто скористатися послугами медико-генетичного консультування.
Для отримання достовірних результатів під час медико-генетичного консультування потрібно знати генотипи батьків і дітей. Для цього використовують різноманітні методи діагностики.
Генеалогічний метод дає змогу визначити механізм успадкування і спрогнозувати ймовірність появи ознаки в нащадків
Найдавніший метод вивчення успадкування ознак у людини — аналіз родоводів, відомий також як генеалогічний метод. Аналіз родоводів може забезпечити дослідника важливою інформацією. По-перше, він дозволяє визначити генетичні механізми успадкування тієї чи іншої ознаки. По-друге, завдяки цьому методу можна припустити ймовірність прояву ознаки в майбутньому — у дітей цієї подружньої пари.

Рис. 37.1. Картина «Королівська родина в 1846 році» зображує родину королеви Вікторії та принца Альберта
Розглянемо, як, аналізуючи родовід, можна дійти висновку про характер успадкування ознаки. Найвідоміший приклад наслідування генетичних захворювань — це успадкування гемофілії в нащадків королеви Вікторії (рис. 37.1). Шлюби дев’ятьох дітей Вікторії з представниками європейських королівських родин дали підставу називати її «бабусею Європи». Загалом у королеви Вікторії було 42 онуки та 85 правнуків1. Із плином часу з’ясувалося, що більшість нащадків королеви мали гемофілію. При цьому простежується дивна закономірність: хворіли лише чоловіки, навіть якщо обоє батьків були здорові. Так, із-поміж дітей російського імператора Миколи II на гемофілію хворів єдиний син, натомість у чотирьох доньок не проявлялися ознаки захворювання (рис. 37.2). Такий тип успадкування характерний для захворювань, зчеплених із Х-хромосомою. Справді, як ми вже з’ясували в § 36, мутація, відповідальна за гемофілію, розташована в Х-хромосомі. Вважається, що ця мутація була в самої королеви Вікторії чи в когось з її батьків (рис. 37.3).
Є й інші способи успадкування ознак, окрім зчеплення з Х-хромосомою. Для них генеалогічні дерева (це інша назва родоводів) мають різний вигляд, описаний у таблиці 37.1.
1 Багато монархів Європи, які живуть нині, є нащадками королеви Вікторії. Серед них королева Великої Британії Єлизавета II, король Норвегії Гаральд V, король Швеції Карл XVI Густав, королева Данії Маргрете II, король Іспанії Філій VI.

Рис. 37.2. Російська імператорська родина Миколи II
Безсумнівно, коли відомо, яким чином успадковується захворювання, можна визначити ймовірність його прояву в дітей. Припустимо, що до медико-генетичної консультації звернулося дві пари, які бажають мати дитину. В обох випадках і чоловік, і дружина здорові. Але в першому випадку брат чоловіка помер від гемофілії, а в другому — брат дружини. Батьки стурбовані: чи є небезпека розвитку захворювання в їхньої майбутньої дитини? У першому випадку батькам не варто хвилюватися — гемофілія не передається за чоловічою лінією, відповідно, у дитини не можуть виникнути подібні проблеми зі здоров’ям. А у другому випадку все складніше: позаяк у брата матері була гемофілія, то є 50 % ймовірність (спробуйте пояснити чому!), що в генотипі матері є хвороботворний алель. Для того, щоб з’ясувати це, необхідно провести генетичні тести іншого характеру.
Для швидкого отримання багатьох копій потрібного фрагменту ДНК використовують полімеразну ланцюгову реакцію
Отже, що ж робити, якщо ми не можемо однозначно з’ясувати генотип, маючи дані про фенотипи і родовід? У таких випадках потрібно визначати генотип молекулярно-генетичними методами. Генетичні захворювання спричинені наявністю мутантних алелей. Такі послідовності нуклеотидів, що відрізняються поміж особинами популяції та проявляються очевидною ознакою (наприклад, генетичним захворюванням), називають генетичними маркерами.

Рис. 37.3. Частина родоводу королеви Вікторії та принца Альберта
Послідовність нуклеотидів мутантного генетичного маркера якраз і відрізняється від послідовності нормального маркера. Відповідно, якщо виявити її наявність у гені, то можна визначити наявність генетичного маркера. Для цього й використовують різні молекулярно-генетичні методи.
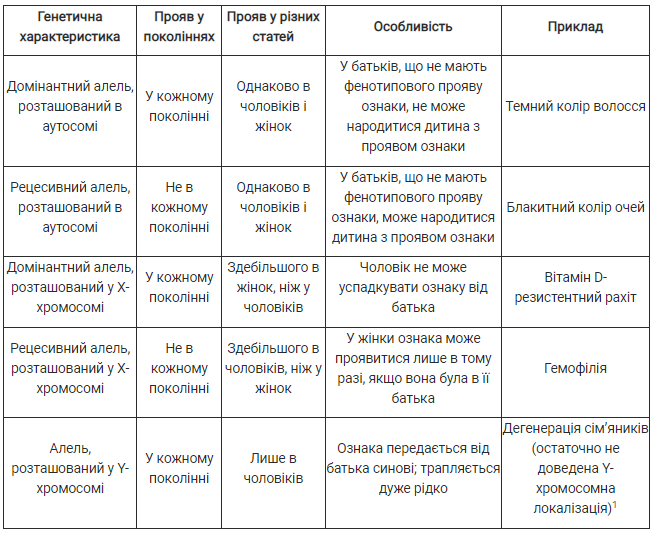
У 1983 році американський біохімік Керрі Мулліс запропонував метод здійснення реплікації специфічної ділянки ДНК у пробірці — полімеразну ланцюгову реакцію (ПЛР). Завдяки ПЛР можна швидко (за годину) синтезувати мільйони копій одного фрагмента ДНК безпосередньо в пробірці (рис. 37.4, А).
ПЛР відкриває безліч можливостей. З одного боку, дослідник може отримати велику кількість копій ділянки ДНК, яка його цікавить, що полегшить йому роботу із цим фрагментом. З іншого боку, можна визначити, чи є така ділянка ДНК у пробі, що нас цікавить. Це забезпечується підбором коротких ланцюжків ДНК, які визначають кордони копійованого регіону — праймерів (рис. 37.4, Б). Праймери комплементарні невеликим ділянкам на краях копійовано регіону. ДНК-полімераза здійснюватиме біосинтез ланцюжків ДНК, починаючи від праймерів. Тому ПЛР буде відбуватися лише тоді, коли праймери зв’яжуться з комплементарними собі ділянками в пробі ДНК. Можна підібрати праймери таким чином, що один із них буде комплементарним лише нуклеотидній послідовності генетичного маркера мутантного алеля. Тоді утворення продукту спостерігатиметься лише за умови наявності в пробі таких алелів. Отже, якщо взяти зразок крові одного з потенційних батьків, виділити з нього ДНК, то потім, під час використання ПЛР, можна визначити наявність у зразку генетичного маркера мутантного алелю. На сьогодні в діагностичних лабораторіях є набір праймерів для маркерів багатьох генетичних хвороб, що дозволяє досить легко й дешево проводити генетичні тести.
Таблиця 37.1. Різні типи успадкування та, їх прояв у генеалогічних деревах
Для виявлення точкових мутацій використовують секвенування нуклеїнових кислот
Якщо особливості ДНК чи відсутність праймерів не дозволяють виявити точкову мутацію за допомогою ПЛР, можна просто розшифрувати всю послідовність нуклеотидів гену, пов’язаного із захворюванням. Таке визначення послідовності нуклеотидів має назву секвенування нуклеїнових кислот. Для цього в спеціальних приладах відщеплюють від кінця одного з ланцюгів ДНК нуклео
тид або прикріплюють комплементарний нуклеотид до другого ланцюга. Надалі визначають, який саме нуклеотид було відщеплено чи прикріплено, й поступово розшифровують всю послідовність гену. Сучасні автоматичні секвенатори здатні визначати послідовності довжиною до мільярда нуклеотидів протягом одного дня!
1 Новітні дослідження спростували уявлення, що гіпертрихоз передається з Y-хромосомою. Взагалі в людини наразі не виявлено жодної такої ознаки. Є припущення, що одна з форм гіпертонії в щурів є прикладом Y-хромосомного успадкування.
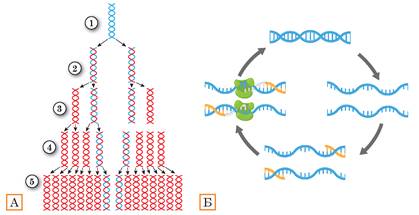
Рис. 37.4. Полімеразна ланцюгова реакція
А. Копіювання ДНК під час ПЛР. 1. Вихідна молекула ДНК. 2. Після першого циклу (2 копії). 3. Після другого циклу (4 копії). 4. Після третього циклу (8 копій). 5. Після четвертого циклу (16 копій). Б. Події, що відбуваються протягом одного циклу ПЛР. Спершу ділянка ДНК розплітається під час нагрівання проби. Потім до країв ділянки ДНК, яка цікавить дослідника, приєднуються комплементарні їм праймери. Після цього термостійка ДНК-полімераза синтезує ДНК, починаючи з праймерів. Наприкінці циклу кількість послідовностей фрагмента подвоюється.
Для пошуку порушень хромосом використовують флуоресцентну гібридизацію
Із попереднього параграфа ви дізналися, що значна кількість генетичних захворювань людини пов’язана з хромосомними аномаліями. Сучасним і точним методом пошуку хромосомних порушень є флуоресцентна гібридизація. У ньому використовують одноланцюгові фрагменти ДНК, позначені флуоресцентним барвником1. Мічена ДНК має послідовність, що відповідає можливому порушенню в структурі хромосоми. Якщо послідовність міченої ДНК відповідає певному фрагменту з проби ДНК, то вони зв’язуються — гібридизуються. Далі під флуоресцентним мікроскопом за наявністю світіння фрагмента можна визначити, чи відбулася гібридизація та чи є той фрагмент, що шукаємо, у пробі (рис. 37.5).
Каріотипування дозволяє виявляти хромосомні порушення на ранніх етапах розвитку зародка
Часто для пошуку хромосомних порушень потрібен аналіз усього каріотипу — каріотипування. Для цього здійснюють виділення хромосом із окремих клітин людини, їх спеціальне фарбування й ідентифікацію. Під дією хімічних барвників хромосоми набувають смугастого забарвлення, при цьому кожна хромосома має свою унікальну послідовність смуг (рис. 37.6). Таке фарбування хромосом дає змогу розподілити їх за парами, а також виявити ті чи інші аномалії в їхній будові або кількості, тобто наявність у геномі хромосомних чи геномних мутацій.
1 Флуоресценція — це здатність речовини випромінювати власне світло при освітленні. Так, флуоресцентні фарби чи тонік світяться при освітленні їх ультрафіолетом.
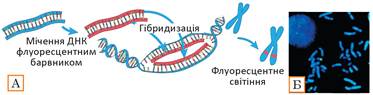
Рис. 37.5. Флуоресцентна гібридизація
А. Мічені флуоресцентним барвником одноланцюгові фрагменти ДНК зв’язуються з комплементарними ділянками проби ДНК. Цим підтверджується наявність даних ділянок і визначається місце їх розташування. Б. Хромосоми з фрагментами, що світяться, у інтерфазі (ліворуч) та метафазі (праворуч) клітинного циклу.

Рис. 37.6. Каріотип здорової людини
А. Зовнішній вигляд зафарбованих хромосом, виділених із клітини, що ділиться. Б. Упорядковані хромосоми з попереднього зображення.

Рис. 37.7. Методи отримання клітин зародка
А. Забір клітин плаценти. Б. Забір навколоплідної рідини. 1. Апарат ультразвукової діагностики. 2. Шприц. 3. Плацента. 4. Плід. 5. Навколоплідна рідина.
Дуже часто каріотипування використовують під час пренатальної діагностики. Її проводять до пологів із метою виявлення тих чи інших генетичних відхилень у зародка ще на стадії внутрішньоутробного розвитку. Для цього здійснюють забір клітин ембріона, а потім каріотипують їх. Самого ембріона під час процедури торкатися не можна, щоб не нашкодити його розвитку. Тому для аналізу беруть або клітини ембріональної частини плаценти, або навколоплідну рідину (рис. 37.7).
Цікаве життя
Каріотипування використовується не лише в генетиці людини. Так, каріотипування часто застосовують для ідентифікації видів-двійників. Наприклад, багато видів малярійних комарів майже не відрізняються один від одного зовнішньо, але значно різняться будовою хромосом. Визначення виду комара становить практичний інтерес, оскільки не всі їхні види (усього понад 400) є хазяїнами малярійного плазмодія.
Життєві запитання — обійти не варто!
Елементарно про життя
• 1. До завдань медико-генетичного консультування НЕ належить
А з’ясування ймовірності народження наступної дитини з генетичною вадою
Б надання рекомендацій щодо переривання вагітності, якщо зародок має генетичні дефекти
В оцінка ймовірності виникнення генетичних порушень у нащадків
Г надання порад щодо лікування й реабілітації дитини з генетичним порушенням
Д з’ясування ступеня спорідненості між батьками
• 2. Який генетичний механізм успадкування хвороби, що її досліджено на схемі родоводу?
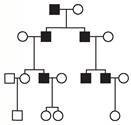
А аутосомний домінантний тип успадкування
Б аутосомний рецесивний тип успадкування
В зчеплений із Х-хромосомою домінантний тип успадкування
Г зчеплений із Х-хромосомою рецесивний тип успадкування
Д зчеплений із Y-хромосомою
• 3. Якщо відбулася делеція ділянки хромосоми, то в результаті флуоресцентної гібридизації відносно неї спостерігатиметься світіння
А лише в одній із двох гомологічних хромосом
Б в обох гомологічних хромосомах
В в іншому місці хромосоми
Г на іншій негомологічній хромосомі
Д в усіх хромосомах без винятку
• 4. Метод отримання клітин для каріотипування з навколоплідної рідини потребує додаткового нарощування клітинної маси, бо в навколоплідній рідині
А забагато клітин зародка
Б замало клітин зародка
В немає клітин зародка
Г наявні лише клітини матері
Д немає клітин матері
У житті все просто
• 5. Виведіть формулу для підрахунку кількості молекул ДНК після 30 циклів ПЛР, якщо в початковому зразку було N молекул ДНК із відповідними фрагментами.
• 6. Як можна застосувати флуоресцентну гібридизацію для каріотипування?
У житті все не так просто
• 7. Порівняйте принципи різних методів секвенування. Який із них найшвидший, а який найдешевший?
Проект для дружної компанії
• 8. Самостійна робота з визначення типів успадкування ознак за генеалогічними деревами.
1) Знайдіть в Інтернеті приклади генеалогічних дерев для різних типів успадкування.
2) Оформіть по два дерева на аркуші А4.
3) Запропонуйте вчителеві/вчительці провести самостійну роботу для однокласників/однокласниць із визначення генетичних ознак генеалогічним методом, використовуючи ваші дерева.
Коментарі (0)