Посттрансляційне дозрівання білків
- 15-09-2021, 22:36
- 821
10 Клас , Біологія і екологія 10 клас Задорожний (профільний рівень)
§ 44. Посттрансляційне дозрівання білків
Поміркуйте
Як клітина виходить із ситуації, коли білок після свого синтезу не здатен самостійно утворювати потрібну для його функціонування третинну структуру молекули?
Згадайте
Будова амінокислот
Радикали амінокислот
Гідрофільність, гідрофобність
Третинна і четвертинна структури білків
Дозрівання білка
Після закінчення синтезу може відбуватися процес посттрансляційного дозрівання білка. Посттрансляційні зміни включають видалення фрагментів поліпептидного ланцюга, приєднання небілкової частини, остаточне формування просторової структури молекули. У результаті формується функціонально активний білок.
Фолдінг
Залишаючи рибосому, поліпептидний ланцюг згортається, і білок набуває певної просторової структури (конформації). Процес спонтанного згортання поліпептидного ланцюга має назву фолдінг.
Кінцева форма білкової молекули багато в чому зумовлена його первинною структурою, тобто послідовністю амінокислот у поліпептидному ланцюжку. Властивості амінокислот, такі як електричний заряд, гідрофільність і гідрофобність, визначають характер їх взаємодії одна з одною і клітинним оточенням.
Наприклад, у глобулярних цитоплазматичних білків гідрофобні амінокислотні залишки занурюються в глиб молекули, а гідрофільні розподіляються по поверхні. Також формування структури білка визначається утворенням зв’язків (гідрофобних, електростатичних та ін.) між радикалами амінокислотних залишків (мал. 44.1). Для підтримання конформації білкових молекул величезне значення має формування ковалентних дисульфідних зв’язків між атомами Сульфуру бічних радикалів цистеїну.
У результаті формується і підтримується третинна структура білка, що обумовлює його властивості й функції. Зокрема, в молекулах ферментів формуються активні центри, що виконують каталітичні функції. На окремих поліпептидах у складі білків з четвертинною структурою формуються поверхні, що контактують завдяки нековалентним зв’язкам (гідрофобним, йонним, водневим). У молекулах білків клітинних мембран формуються канали для трансмембранного транспорту речовин.
Неправильна просторова структура спричиняє утворення неактивних білків, які порушують нормальну роботу клітини і навіть усього організму. Яскравими прикладами цього є утворення пріонних білків, що призводять до руйнування нервової тканини або формування аномального гемоглобіну, що викликають серповидноклітинну анемію.
Порушення третинної структури білка — денатурація — відбувається за зміни внутрішньоклітинних умов, зокрема, у разі підвищення температури, зміни кислотності. За незначних пошкоджень можливе відновлення структури і функцій — ренатурація.
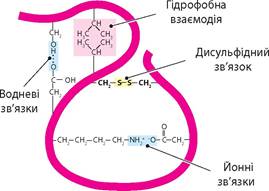
Мал. 44.1. Зв'язки, що стабілізують третинну структуру молекули білка
Шаперони
У фолдінгу деяких білків беруть участь білки шаперони. Вони допомагають синтезованим білкам згортатися в правильну конформацію (мал. 44.2).
Шаперони не тільки беруть участь у фолдінгу дозріваючих ланцюгів, але й допомагають пошкодженим білкам знову набути правильної конформації. Наприклад, синтез шаперонів певного класу (білків теплового шоку), що беруть участь у стабілізації пептидів, зростає за підвищення температури та інших формах стресу. При цьому вони захищають білки клітини від денатурації.

Мал. 44.2. Принцип роботи шаперонів
Посттрансляційні модифікації
Після завершення трансляції велика частина білків піддається подальшим хімічним модифікаціям.
Відомо більше двохсот варіантів посттрансляційних модифікацій білків. Багато з них здійснюються на мембранах ендоплазматичного ретикулуму. Білки піддаються ацетилюванню, глікозилюванню, фосфорилюванню та іншим хімічним перетворенням. Наприклад, глікозилювання є необхідним етапом дозрівання білків плазматичної мембрани. Для багатьох білків, особливо ферментів, важливим є приєднання небілкового компонента (простетичної групи). Обмежений протеолізнеобхідний для активування неактивних білків-попередників. Таким чином, наприклад, прогормони перетворюються на гормони. У деяких випадках від поліпептидних ланцюгів можуть видалятися кінцеві амінокислоти, або приєднуватися сигнальні пептиди для виходу молекули білка з клітини. Крім того, для формування складних білків необхідне утворення зв’язків між окремими ланцюгами (наприклад, у молекулі гемоглобіну об’єднуються чотири окремі ланцюги).
Синтез і дозрівання цитоплазматичних, мембранних і секреторних білків
Водорозчинні білки для внутрішніх потреб цитоплазми синтезуються на рибосомах, вільно розташованих у цитоплазмі. Такі білки згортаються в процесі виходу з рибосоми у водному оточенні, формуючи глобулярну структуру з полярною поверхнею і гідрофобним ядром усередині.
Мембранні білки або секреторні білки, які виводяться з клітини через мембрани, синтезуються на рибосомах, пов’язаних з мембранами ендоплазматичного ретикулуму. Після синтезу білки зовнішніх мембран убудовуються в мембрану ендоплазматичного ретикулуму і доставляються до апарату Гольджі, а потім — до поверхні клітини.
Секреторні білки також транспортуються до апарату Гольджі, але не по мембранах, а по по каналах ендоплазматичного ретикулуму. Для подальшого транспорту вони пакуються апаратом Гольджі у секреторні пухирці.
У каналах ендоплазматичного ретикулуму і цистернах апарату Гольджі білки дозрівають — підлягають посттрансляційним модифікаціям.
Ключова ідея
Після трансляції відбувається фолдінг — згортання поліпептидного ланцюга у просторову структуру, яка багато в чому залежить від послідовності амінокислот. У фолдінгу беруть участь білки шаперони. Посттрансляційні модифікації білків включають також хімічні перетворення.
Запитання та завдання
1. Які взаємодії підтримують третинну та четвертинну структури білка? 2. Поясніть, як помилка в гені (заміна одного нуклеотиду на інший) може призвести до порушень обміну речовин. Використовуйте ваші знання про генетичний код, фолдінг, ферментативний каталіз, метаболічні шляхи. 3. Чим просторова структура цитоплазматичних білків відрізняється від структури мембранних білків? 4. Поясніть значення обмеженого протеолізу в дозріванні білків.
Коментарі (0)