Ферменти
- 11-11-2021, 23:01
- 1 225
9 Клас , Біологія 9 клас Шаламов, Носов, Литовченко, Каліберда
§ 6. Ферменти
У клітинах відбуваються реакції, неможливі без каталізаторів
Як ми вже знаємо з попередніх параграфів, у клітинах живих організмів є надзвичайно багато різноманітних молекул. Ці молекули не тільки становлять основу клітин і тканин, із яких побудовані організми, а й вступають у хімічні реакції одна з одною. В організмі відбуваються найрізноманітніші процеси хімічних перетворень молекул: розщеплення полімерів їжі до мономерів, дихання, фотосинтез, синтез нових білків з амінокислот тощо. Багато із цих реакцій супроводжуються виділенням енергії, яку може використовувати організм, а інші, навпаки, вимагають додаткового джерела енергії. Розглянемо просту реакцію розкладання карбаміду (інша назва цієї речовини — сечовина) у воді:
(NH2)2CO + H2O = 2NH3 + CO2
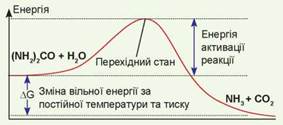
Рис 6.1. Енергетичний профіль реакції розкладу карбаміду у воді
Така реакція не потребує додаткового джерела енергії, оскільки речовини, що реагують, мають більшу енергію, ніж продукти реакції. Ця реакція відбувається довільно. На рисунку 6.1 зображено зміну енергії реагентів у ході реакції. Такий графік має назву енергетичний профіль реакції. Помістимо невелику кількість карбаміду в пробірку з водою й спостерігатимемо за процесом виділення амоніаку та вуглекислого газу. Енергетичний розрахунок показує, що карбамід має повністю розкластися. Проте швидкість такої реакції дуже мала. Для того, щоб ця реакція відбулася повністю, нам доведеться чекати мільярд років! У чому ж причина такої малої швидкості?
Якщо ми ще раз уважно розглянемо рисунок 6.1, то помітимо, що на енергетичному профілі між реагентами й продуктами є «пагорб» — стан із високою енергією, яка перевищує енергію реагуючих речовин на енергію активації. Якщо подолати цей «пагорб», реакція відбуватиметься дуже швидко, але «видертися» на нього та «переступити» його дуже непросто. Саме це й обмежує швидкість реакції. Але деякі речовини здатні знижувати висоту цього «пагорба», тобто знижувати енергію активації. Такі речовини називають каталізаторами.
Ферменти — біологічні каталізатори
Реакція розкладання карбаміду у воді відбувається дуже повільно. Проте якщо ви додасте до цього розчину перетерте насіння кавуна та піднесете вологий лакмусовий папірець, то відразу помітите, як він почне синішати: це амоніак, що виділяється, створює лужне середовище. Можна припустити, що в кавуновому насінні є каталізатор цієї реакції. Це справді так: цим каталізатором є білок уреаза. Уреаза — лише один із величезного різноманіття каталізаторів білкової природи, які називають ферментами. Ферменти становлять абсолютну більшість каталізаторів у живих організмах. Як і всі білки, ферменти є дуже великими молекулами.
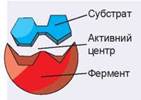
Рис. 6.2. Фермент і його субстрат
На рисунку 6.2 зображено фермент і субстрат реакції (реагент). Взаємодіє із субстратом не вся поверхня ферменту, а лише невеличка її частина, що має назву активний центр. Інша частина формує структурну основу, на якій активний центр фіксується та набуває структури, необхідної для каталізу. Активний центр зазвичай зовсім невеличкий, проте до його складу часто входять віддалені ділянки амінокислотної послідовності. У процесі згортання молекули ферменту ці ділянки опиняються поруч одна з одною.
Принцип роботи ферментів — взаємодія із субстратом
Активний центр — це каталітична ділянка молекули ферменту. Там відбувається зв’язування субстратів реакції та акт каталізу. Субстрати заходять до активного центру та взаємодіють з амінокислотними залишками, спричиняючи зміни в тривимірній структурі ферменту. Формується фермент-субстратний комплекс (рис. 6.3). Часто ці зміни зовсім незначні, але іноді вони глобально перебудовують структуру молекули. Це стосуюється, зокрема, білків-моторів, що виконують механічну роботу. Поспостерігати за тим, як працює білок-мотор, ви можете за посиланням.

Активний центр формує відповідне оточення для здійснення реакції з меншим енергетичним бар’єром, ніж у розчині. Саме це прискорює реакцію в мільйони й навіть сотні мільярдів разів.
У кожній клітині є тисячі різних ферментів, що здійснюють різноманітні реакції. При цьому можна говорити про специфічність ферментативних реакцій: кожен фермент може здійснювати каталіз тільки обмеженої кількості реакцій. Так, фермент амілаза, що міститься в слині, може розщеплювати крохмаль, але не здатний розщепити целюлозу. Специфічність визначається тим, що активний центр має певну форму, доступну для взаємодії з одними субстратами та не доступну для взаємодії з іншими. Деякі ферменти прискорюють лише одну реакцію, натомість інші — багато.
На ферментативну активність впливають чинники середовища
Ферментативний каталіз неможливий без правильного розташування залишків в активному центрі. А розташування амінокислотних залишків в активному центрі визначається правильним згортанням молекули ферменту. У § 3 ми вже з’ясували, що на згортання молекули білка впливають різноманітні фактори зовнішнього середовища: температура, кислотність, солоність.
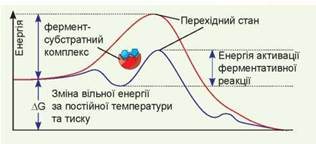
Рис. 6.3. Енергетичний профіль реакції, каталізованої ферментом
Червона лінія — реакція без ферменту, фіолетова лінія — реакція з ферментом.
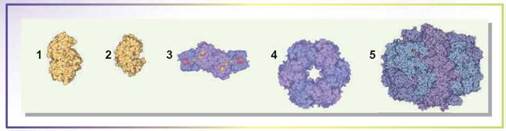
Рис. 6.4. Різноманітність ферментів
Молекули ферментів, як і молекули інших білків, чутливі до варіацій цих факторів: якщо ці параметри не відповідають оптимальним, порушується тривимірна структура ферментів і вони втрачають свою активність. Так, пепсин, що є компонентом шлункового соку людини, активний у кислому середовищі шлунка, проте втрачає свою активність у слабколужному середовищі кишківника. Більшість ферментів дуже чутливі до змін температури. Під час нагрівання вище за 60 °С вони припиняють працювати. Але ферменти бактерій, що живуть у гарячих джерелах, часто оптимально працюють за температури 70-80 °С.
Ферменти надзвичайно різноманітні
Ми вже згадали на початку параграфа, що в живих організмах відбувається величезна кількість різноманітних біохімічних реакцій, що каталізуються ферментами. Ферменти класифікують за каталізованими реакціями, будовою і клітинною локалізацією. На рисунку 6.4 зображено деякі ферменти, що є в живих організмах.
- 1. Амілаза — позаклітинний фермент, що здійснює розщеплення крохмалю. У людини він міститься в слині та секреті підшлункової залози. У момент проростання зернин злаків активно синтезується зародком і здійснює розклад крохмалю, накопиченого в ендоспермі (поясніть, для чого).
- 2. Пепсин — фермент, що міститься в шлунковому соці. Здійснює розщеплення білків. Активний у кислому середовищі.
- 3. Нітрогеназа — фермент, що синтезується азотфіксувальними бактеріями. Здійснює перетворення атмосферного азоту в амоніак, відіграє ключову роль у колообігу Нітрогену в природі. Містить атоми Молібдену і Феруму.
- 4. Глутамінсинтетаза — фермент, відповідальний за включення Нітрогену до складу амінокислот. Є в клітинах усіх живих організмів.
- 5. Синтаза жирних кислот — великий цитоплазматичний фермент, що здійснює синтез жирних кислот — компонентів жирів. У бактерій це мультиферментний комплекс, а в людини — димер, що містить багато різних активних центрів.
Поміркуймо
Знайдіть одну правильну відповідь
1. На рисунку до завдання № 4 цифрою 5 позначено
- А активний центр ферменту
- Б субстрат
- В фермент-субстратний комплекс
- Г продукт реакції
- Д фермент-продуктний комплекс
2. Енергією тваринні організми забезпечує процес
- А біосинтезу білка
- Б синтезу ліпідів
- В перетравлювання їжі
- Г фотосинтезу
- Д дихання
3. На графіку, що зображує зміну енергії в ході хімічної реакції, літерою Х позначено
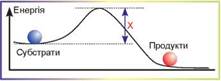
- А енергію субстратів
- Б енергію продуктів
- В енергію ферменту
- Г енергію активації
- Д різницю енергії продуктів і субстратів
4. Цифрою 2 на рисунку позначено
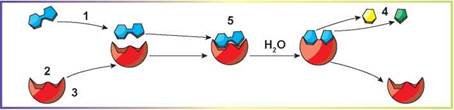
- А активний центр ферменту
- Б субстрат
- В фермент-субстратний комплекс
- Г продукт реакції
- Д фермент-продуктний комплекс
Сформулюйте відповідь кількома реченнями
5. Як активність ферментів залежить від факторів довкілля?
6. Чи витрачається фермент під час ферментативної реакції? Чому?
7. Яка з ділянок молекули ферменту безпосередньо відповідає за каталіз?
8. Що таке специфічність ферменту? Чому вона важлива для живої природи?
Знайди відповідь і наблизься до розуміння природи
9. Термофільні організми мешкають у місцях із високою температурою довкілля (наприклад, у гарячих джерелах). Які особливості повинні мати ферменти, що є в цих організмах? Зроби припущення, як можуть бути використані ці ферменти на практиці?
10. Зазвичай швидкість хімічної реакції збільшується з підвищенням температури (у середньому в 2-4 рази на кожні 10 градусів). Чи завжди це твердження справедливе для реакцій, які каталізуються ферментами?
Дізнайся самостійно та розкажи іншим
11. Які властивості повинні мати біологічні молекули, щоб виконувати роль каталізаторів? Чому білки якнайліпше підходять для цієї функції?
12. Як, для чого та які ферменти використовують у промисловості?
Проект для дружної компанії
13. Використовуючи різноманітні матеріали (папір, картон, нитки, ґудзики, пластилін тощо), зробіть модель ферментативної реакції. Покажіть модель у класі та поясніть, що вона демонструє. Якщо зі справжніми матеріалами працювати ліньки, створіть подібну віртуальну модель на комп’ютері й покажіть її в класі.
Коментарі (0)