Гідроліз солей
- 14-11-2023, 15:03
- 320
11 клас , Хімія 11 клас Лашевська (рівень стандарту)
§ 10. Гідроліз солей
Після опрацювання параграфа ви зможете:
- характеризувати суть гідролізу солей;
- експериментально визначати pH середовища водних розчинів солей за допомогою індикаторів;
- прогнозувати можливість реакції гідролізу солей; pH середовища водних розчинів солей;
- складати рівняння реакцій гідролізу солей.
• Грец. ΰδωρ — вода, λύσις - розкладання. Поясніть, про що, на вашу думку, ідеться в параграфі. Пригадайте, чи траплявся вам цей термін раніше. У якому контексті?
Розчинні солі — сильні електроліти. Про це ви дізналися в курсу хімії 9 класу. Тобто у водних розчинах вони дисоціюють повністю та необоротно з утворенням гідратованих йонів.
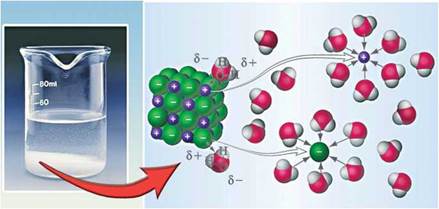
Рис. 10.1. Розчинення натрій хлориду у воді: макро- і мікрорівні
• За рисунком 10.1 поясніть, які процеси відбуваються під час розчинення у воді натрій хлориду, та складіть рівняння його електролітичної дисоціації. Чи є у водному розчині натрій хлориду катіони Гідрогену або гідроксид-іони? Спрогнозуйте забарвлення універсального індикаторного папірця в цьому розчині та перевірте свій прогноз експериментально.
Лабораторний дослід 1
Визначення pH середовища водних розчинів солей за допомогою індикаторів
Пригадайте та неухильно виконуйте
ПРАВИЛА БЕЗПЕКИ ПІД ЧАС РОБОТИ З ОБЛАДНАННЯМ І РЕАКТИВАМИ
Обладнання: штатив з пробірками або пластина із заглибинами, піпетки або скляні палички, універсальний індикаторний папір.
Реактиви: водні розчини солей - натрій хлориду, натрій карбонату, алюміній хлориду.1
Завдання. Визначте pH середовища виданих вам водних розчинів солей.
Результати досліду запишіть до таблиці за зразком:

Результати досліду, мабуть, виявилися для вас дещо несподіваними. Ви правильно спрогнозували, що середовище водного розчину натрій хлориду нейтральне й, напевно, вважали, що середовище водних розчинів усіх солей має бути нейтральним. Адже внаслідок електролітичної дисоціації солей утворюються катіони металічних елементів2 й аніони кислотних залишків, а ступінь дисоціації води на катіони Гідрогену й гідроксид-аніони мізерно малий3.
1 Та/або інших солей на розсуд учителя або вчительки хімії.
2 Унаслідок дисоціації солей амонію - катіони амонію.
3 Лише одна молекула води з 550 000 її молекул дисоціює на катіон Гідрогену та гідроксид-іон.
Спробуймо з’ясувати причину виявленої суперечності. Проаналізуймо хімічний склад натрій хлориду, натрій карбонату, алюміній хлориду з огляду на те, з яких катіонів і аніонів складаються їхні кристали і продуктами взаємодії яких кислот й основ є ці солі.
Натрій хлорид складається з катіонів Натрію та хлорид-аніонів, тобто є продуктом реакції між сильними електролітами - натрій гідроксидом і хлоридною кислотою. Натрій карбонат складається з катіонів Натрію та карбонат-аніонів, тобто є продуктом реакції між сильною основою натрій гідроксидом і слабкою карбонатною кислотою. Алюміній хлорид складається з катіонів Алюмінію та хлорид-аніонів, тобто є продуктом реакції між слабкою основою алюміній гідроксидом і сильною хлоридною кислотою.
Отже, можна виявити певні закономірності. Назвіть їх, проаналізувавши схему на рисунку 10.2.
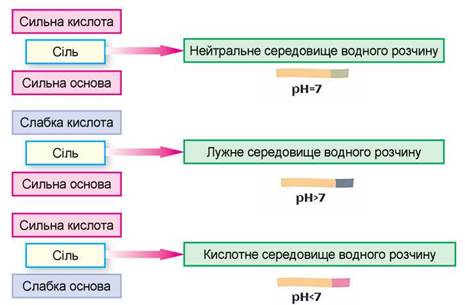
Рис. 10.2. Характер середовища водного розчину солі залежить від сили відповідних кислоти та основи
Звідки ж узявся в розчинах солей надлишок катіонів Гідрогену або гідроксид-іонів? Адже саме вони зумовлюють кисле або лужне середовище. Вочевидь, якщо до складу солі входять йони, яким відповідають слабка основа або слабка кислота, процес розчинення не обмежується лише переходом катіонів й аніонів солі в розчин.
Аніони солі, утвореної слабкою кислотою, узаємодіятимуть з молекулами води. Унаслідок реакції обміну утворюватимуться молекули слабкої кислоти та гідроксид-іони. Тож розчин солі матиме лужну реакцію:
Аніонn- + НОН ⇄ НАніон(n-1)- + ОН-.
Аналогічно катіони слабкої основи зв’язуватимуть гідроксид аніони з утворенням надлишку катіонів Гідрогену:
![]()
Тож тепер зрозуміло, що відбулося у водному розчині натрій карбонату:
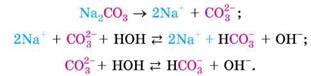
Зверніть увагу: карбонат-аніон двозарядний, тож можливе приєднання ним ще одного катіона Гідрогену:
![]()
Тобто процес гідролізу натрій карбонату двостадійний:
![]()
Зверніть увагу: на другій стадії лише незначна частка гідрогенкарбонат-іонів з-поміж тих, що утворилися на першій стадії, зазнає гідролізу. Рівновага гідролізу натрій карбонату на другій стадії зміщена вліво порівняно з рівновагою першої стадії, оскільки на першій стадії утворюється слабший електроліт (НСО-3), ніж на другій (Н2СО3). Тому записувати сумарне рівняння й скорочувати формули йонів, що беруть участь у гідролізі, не можна.
Так само поетапно відбувається гідроліз алюміній хлориду:
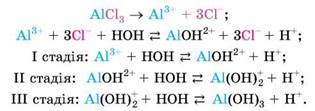
Зверніть увагу: гідроліз на другій стадії відбувається в значно меншому ступені, ніж на першій, а на третій - майже не відбувається. Про це свідчить прозорість розчину. Тобто алюміній гідроксиду утворюється так мало, що на просте око побачити його неможливо.
• Перетворіть скорочені йонні рівняння кожної зі стадій реакцій гідролізу натрій карбонату та алюміній хлориду на молекулярні.
А якщо слабкі обидві - і основа, і кислота, з катіонів й аніонів яких складається сіль? У цьому разі гідроліз також відбувається, бо катіони слабкої основи зв’язують гідроксид аніони, а аніони слабкої кислоти - катіони Гідрогену. Тобто відбуватимуться дві незалежні оборотні реакції. Тож яких йонів - Н+ чи ОН- - у розчині виявиться більше, залежить від ступеня перебігу кожної з них.
Унаслідок зв’язування гідроксид-іонів і йонів Гідрогену їхній вміст у розчині зменшується. Тож згідно з принципом Ле Шательє рівновага реакції обміну між сіллю й водою зміщуватиметься в бік утворення продуктів гідролізу аж до повного гідролізу солі в окремих випадках.
• Алюміній сульфід у розчині зазнає повного гідролізу. Ця реакція необоротна, бо її продукти - нерозчинний алюміній гідроксид і газуватий гідроген сульфід - виводяться з реакційного середовища. Складіть рівняння цієї реакції в молекулярній формі, не забувши зазначити утворення осаду й виділення газу.
ПРО ГОЛОВНЕ
• Гідроліз солі - реакція йонного обміну між йонами солі та молекулами води, унаслідок якої середовище розчину солі може стати відмінним від нейтрального.
• Гідроліз солі, утвореної слабкою основою й сильною кислотою, - це гідроліз за катіоном. Унаслідок цього середовище розчину стає кислотним;
• Катіонn+ + НОН ⇄ КатіонОН(n-1)+ + ОН+.
• Гідроліз солі, утвореної сильною основою та слабкою кислотою, - це гідроліз за аніоном. Унаслідок цього середовище розчину стає лужним.
• Аніонn- + НОН ⇄ НАніон(n-1)- + ОН-.
• Щоб скласти рівняння реакції гідролізу солі, складаємо рівняння її електролітичної дисоціації. Визначаємо йон слабкого електроліту. Записуємо йонне рівняння реакції гідролізу за участі цього йона. Визначаємо середовище розчину солі.
Перевірте себе
- 1. Перетворіть розповідні речення рубрики ПРО ГОЛОВНЕ на питальні. Чи можете ви відповісти на ці запитання без допомоги підручника?
Застосуйте свої знання й уміння
- 2. Спрогнозуйте характер середовища у водних розчинах цинк сульфату, літій сульфіду, ферум(ІІІ) хлориду, калій карбонату, натрій етаноату. Складіть рівняння відповідних реакцій.
- 3. Проаналізуйте інформацію: 1) алюміній сульфід добувають нагріванням суміші алюмінію із сіркою та зберігають у щільно закоркованій посудині. За зберігання на повітрі він перетворюється на розпливчасту масу з неприємним запахом тухлих яєць; 2) якщо у водний розчин цинк хлориду занурити цинкову пластинку, почнуть виділятися бульбашки газу; 3) унаслідок зливання водних розчинів натрій карбонату та ферум(ІІІ) хлориду випадає бурий осад і виділяється газ; 4) середовище водного розчину мила (пригадайте його хімічний склад) лужне. Поясніть ці явища, складіть рівняння відповідних реакцій на підтвердження своїх міркувань.
- 4. Поясніть, добавляння яких речовин до розчину ферум(ІІІ) хлориду підсилить його гідроліз: а) хлоридна кислота; б) натрій гідроксид; в) магній хлорид; г) натрій карбонат. Відповідь обґрунтуйте.
- 5. У таблиці розчинності на місці купрум(ІІ) карбонату прочерк. Лише в 1959 році цю речовину добули за особливих умов - 150 °С в атмосфері вуглекислого газу під тиском 60-80 атм. Поясніть, чому не можна добути цю сіль реакцією йонного обміну в розчині.
- 6. Порівняйте відомі вам реакції гідролізу за участі органічних і неорганічних речовин. Відповідь оформте як таблицю або діаграму Венна.
Творча майстерня
- 7. Складіть сенкан «Гідроліз» або/та мнемонічне правило, що дає змогу передбачити характер середовища водного розчину певної солі.
Коментарі (0)