Кислоти
- 14-11-2023, 22:47
- 310
11 клас , Хімія 11 клас Лашевська (рівень стандарту)
§ 22. Кислоти
Після опрацювання цього параграфа ви зможете:
- називати кислоти;
- складати рівняння, що підтверджують хімічні властивості кислот, реакцій нітратної та концентрованої сульфатної кислот з магнієм, цинком, міддю;
- характеризувати їхні фізичні та хімічні властивості.
Називати кислоти та складати рівняння реакцій, що підтверджують їхні загальні хімічні властивості, ви вже вмієте. Застосуйте ці вміння під час виконання1 завдань, наведених далі.
1 Які саме завдання виконувати, працювати індивідуально чи в групі, вам порадить учитель або вчителька хімії.
• 1. Класифікуйте кислоти, хімічні формули яких НСl, H2S, H2SO3, H2SO4, HNO3, H3PO4 ..., за якісним і кількісним складом, силою, леткістю тощо. 2. Складіть рівняння електролітичної дисоціації цих кислот. Які з них дисоціюватимуть практично повністю? Які - ступінчасто? Які можуть утворювати кислі солі? Якого кольору набуде у водних розчинах цих кислот універсальний індикатор? Значення показника pH цих розчинів більше чи менше від семи? 3. Складіть рівняння реакцій, використавши наведені в завданні формули: а) одноосновної безоксигенової кислоти із цинком; б) двоосновної оксигеновмісної сильної кислоти з купрум(ІІ) оксидом; в) одноосновної оксигеновмісної кислоти з купрум(ІІ) гідроксидом; г) двоосновної слабкої оксигеновмісної кислоти з натрій гідроксидом; д) трьохосновної оксигеновмісної кислоти з натрій карбонатом; е) двоосновної безоксигенової кислоти з плюмбум(ІІ) нітратом. Розгляньте ці реакції з погляду електролітичної дисоціації, а окисно-відновну - ще й з погляду окиснення-відновлення.
Фізичні й хімічні властивості сульфатної та нітратної кислот. Порівняти фізичні властивості нітратної та сульфатної кислот ви зможете самостійно, проаналізувавши відомості, наведені в таблиці 22.1 (зробіть це, визначивши за зображеннями моделей молекул, про яку кислоту йдеться в кожній колонці).
Таблиця 22.1. Фізичні властивості нітратної та сульфатної кислот2
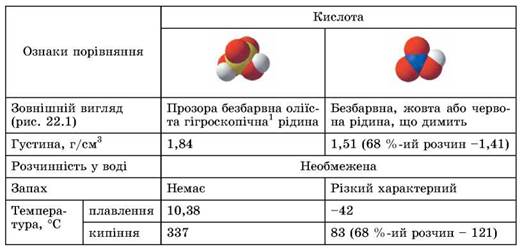
2 Від давн.-грец. υγρός - вологий + σκοπεω - спостерігаю - здатність деяких речовин поглинати водяну пару з повітря.

Рис. 22.1. Сульфатна (1) та нітратна (2) кислоти
• 1. На прикладі сульфатної кислоти прокоментуйте мнемонічне правило приготування її розчинів: «Кислоту - у воду!». 2. Унаслідок розкладання нітратної кислоти утворюються нітроген(ІV) оксид, кисень і вода. Який з продуктів цієї реакції дістав образну назву «лисячий хвіст» і чому?
Схарактеризувати спільні з іншими кислотами властивості сульфатної та нітратної кислот самостійно вам до снаги (зробіть це, узявши до уваги, що сульфатна кислота утворює не лише середні, а й кислі солі). Проте ці кислоти мають низку особливих властивостей. Розгляньмо їх докладніше. Під час виконання одного з попередніх завдань цього параграфа ви мали схарактеризувати з погляду окиснення-відновлення реакцію хлоридної кислоти із цинком. Тож змогли правильно визначити, що окисником у ній є катіони Гідрогену, які відновлюються до водню. Особливістю сульфатної та нітратної кислот є те, що в реакціях з металами (і не лише з ними) окисні властивості можуть виявляти атоми Сульфуру та Нітрогену відповідно. Проаналізуймо із цього погляду реакції нітратної та концентрованої сульфатної кислот з магнієм, цинком та міддю. Експериментально виявлено, що продукти цих реакцій залежать від положення металів у ряду активності, масової частки кислоти, температури тощо. Розглянувши схему, наведену на рисунку 22.2, ви самостійно зможете скласти рівняння реакцій магнію, цинку та міді з нітратною кислотою в розчинах з різною масовою часткою та схарактеризувати їх з погляду окиснення-відновлення (зробіть це індивідуально або в навчальній групі за порадою вчителя або вчительки хімії).
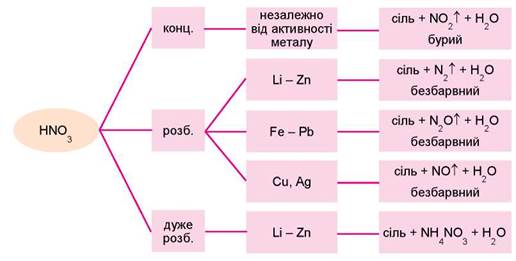
Рис. 22.2. Узаємодія нітратної кислоти з металами
Цікаво і пізнавально
Офорт (франц. eau-forte, буквально - міцна вода; нітратна кислота) - різновид гравюри на металі, за допомогою якого роблять відтиски з друкарських форм, попередньо оброблених кислотами (рис. 22.3).

Рис. 22.3. Знана українська малярка Оксана Стратійчук біля одного з офортів на персональній виставці «Відображення», Абу-Дабі, ОАЕ, 6 грудня 2013 року
https://www.youtube.com/watch?v=T7c4vryyUrE
Аналогічне завдання ви зможете виконати, проаналізувавши схему, наведену на рисунку 22.4 (зробіть це).
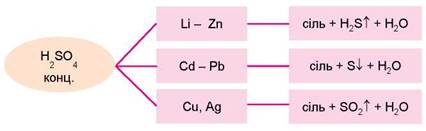
Рис. 22.4. Взаємодія концентрованої сульфатної кислоти з металами
• 1. Органолептичні властивості (від грец. δργανον - знаряддя, інструмент + λεπτικός - брати, приймати) - властивості навколишніх об’єктів, які можна виявити й оцінити за допомогою органів чуття (нюху, зору тощо). Проаналізуйте схему, зображену на рисунку 22.4, і поясніть, чи можна органолептично розрізнити продукти відновлення концентрованої сульфатної кислоти металами різної активності. Інформація, потрібна для правильного виконання завдання, є в попередніх параграфах.
Холодна концентрована нітратна кислота так само як і холодна концентрована сульфатна кислота пасивують алюміній, залізо та деякі інші метали. Під дією кислот на поверхні металів утворюється щільна оксидна плівка, яка захищає його від подальшої дії кислоти.
Цікаво і пізнавально
Як було зауважено, положення металів у ряду активності, масова частка кислоти, температура тощо впливають на продукти відновлення нітратної та концентрованої сульфатної кислот у їхніх реакціях з металами. У багатьох підручниках хімії ви натрапите на категоричні твердження на кшталт: «Унаслідок реакції нітратної кислоти з магнієм водень не утворюється», «Залізо не реагує з концентрованою нітратною кислотою». Проаналізувавши графіки, зображені на рисунку 22.5, ви зможете дійти певних висновків (зробіть це).
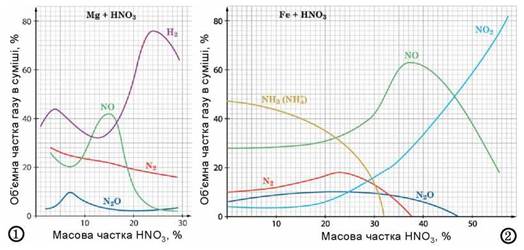
Рис. 22.5. Уміст газуватих продуктів реакцій магнію та заліза з нітратною кислотою залежно від масової частки кислоти (авт. графіків О. Михайліченко)
• 1. Визначте за графіком 1, за якої масової частки нітратної кислоти в реакційній суміші максимальним є вміст: а) водню; б) нітроген(ІІ) оксиду; в) нітроген(І) оксиду; г) азоту. 2. Проаналізувавши графік 2, доповніть твердження: а) «Зі збільшенням масової частки нітратної кислоти вміст у реакційній суміші катіонів амонію а нітроген(ІV) оксиду б) «У реакційній суміші немає катіонів амонію, молекул азоту, нітроген(І) оксиду, якщо масова частка (%) нітратної кислоти у використаному в досліді розчині становила ..., ... та ... відповідно».
ПРО ГОЛОВНЕ
• Назви безоксигенових кислот складають за алгоритмом:
назва чи фрагмент назви хімічного елемента + ид (ід) + на + кислота.
Приклади: хлор + ид + на + кислота; сульф + ід + на + кислота.
• Назви оксигеновмісних кислот складають за алгоритмом:
назва чи фрагмент назви хімічного елемента + ат (ит) + на + кислота.
Приклади: сульф + ат + на + кислота (H2SO4); сульф + іт + на + кислота (H2SO3).
• Нітратна та сульфатна кислоти виявляють хімічні властивості, загальні для всіх кислот, а також - особливі. Вони - кислоти-окисники не лише за катіонами Гідрогену, а й за атомами Нітрогену й Сульфуру відповідно.
• Продукти реакцій нітратної та сульфатної кислот з металами залежать від положення металів у ряду активності, масової частки кислоти у розчині, температури тощо.
Перевірте себе
- 1. Перетворіть розповідні речення з рубрики ПРО ГОЛОВНЕ на запитальні. Чи зможете ви відповісти на ці запитання без допомоги підручника?
Застосуйте свої знання й уміння
- 2. Є дві однакові прозорі скляні посудини. В одній - концентрована нітратна, в іншій - концентрована сульфатна кислота. Запропонуйте якомога більше способів розрізнення цих речовин, що ґрунтуються на їхніх властивостях: а) фізичних; б) хімічних; в) органолептичних.
- 3. На платформу електронних ваг поставили хімічний стакан з концентрованою кислотою. Спрогнозуйте, чи зміниться маса стакана з кислотою із часом для кислот: а) сульфатної; б) нітратної. Відповідь обґрунтуйте.
- 4. На рисунку 22.6 зображено дію того самого розчину нітратної кислоти на метали. Роздивіться його та зробіть висновок щодо того, концентровану чи розбавлену нітратну кислоту, використано для проведення досліду. Відповідь ілюструйте двома хімічними рівняннями, складеними в загальному вигляді, у яких замість хімічних символів двовалентних металічних елементів використано літеру X, а замість символа одновалентного металічного елемента - Y. Складіть для цих рівнянь електронний баланс, визначте окисник і відновник. Висловте припущення щодо того, який метал на рисунку позначено літерою Z, та обґрунтуйте його. Як би ви відрізнили пробірку, у якій відбулася реакція нітратної кислоти з міддю, від інших пробірок?

Рис. 22.6. Дія того самого розчину нітратної кислоти на магній (1), цинк (2), мідь (3), срібло (4), Z (5)
- 5. Є три пробірки. У першій - концентрована нітратна, у другій - концентрована сульфатна, у третій - концентрована хлоридна кислота. До отворів пробірок піднесли скляні палички, змочені концентрованим водним розчином амоніаку. Спрогнозуйте, які зміни відбулися, і поясніть чому.
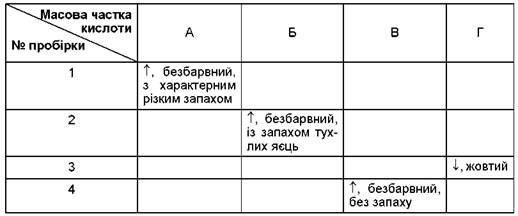
- 6. Експериментально встановлено: чим розбавленіша сульфатна кислота, тим глибше відбувається відновлення. У чотири пробірки помістили магній і подіяли на нього розчинами з різним умістом сульфатної кислоти. Проаналізуйте наведену в таблиці інформацію щодо змін, які відбулися в кожній пробірці, та розташуйте літери А - Г за збільшенням масової частки сульфатної кислоти у використаних у досліді розчинах.
- 7. Створіть діаграму Вена, яка відображає загальні з іншими кислотами та особливі властивості нітратної та сульфатної кислот.
Творча майстерня
- 8. Складіть сенкан про властивості нітратної або сульфатної кислоти.
Коментарі (0)