Жорсткість води та способи її усунення
- 15-11-2023, 22:50
- 430
11 клас , Хімія 11 клас Ярошенко (рівень стандарту)
§ 28. Жорсткість води та способи її усунення
Вам відомо, що абсолютно чистих речовин не існує. Дощова, річкова чи морська вода, підземні води завжди містять домішки, серед яких найпоширенішими є солі. Тому природна вода буває і жорсткою, і м'якою.
Жорстка вода створює несприятливі умови для функціонування приладів, робота яких пов'язана з гарячою водою, погіршує прання, приготування їжі тощо.
Якщо у складі питної чи мінеральної води катіони Кальцію і Магнію є корисними у визначених межах споживання, то для води, у якій перуть білизну, яку кип'ятять (під час приготування страв, чаю, кави тощо), використовують у системах опалення приміщень, їх наявність небажана і до певної міри шкідлива.
ПОНЯТТЯ ПРО ЖОРСТКІСТЬ ВОДИ. З наявністю у воді солей Кальцію і Магнію — гідрогенкарбонатів, хлоридів та сульфатів — пов'язане поняття жорсткість води.
Жорсткість води — сукупність властивостей води, зумовлена наявністю катіонів Са2+ і Mg2+. Ці йони входять до складу солей хлоридів, сульфатів, гідрогенкарбонатів.
Вода, 1 л якої містить до 2 ммоль/л йонів Са2+ і Mg2+, вважається м'якою. Вода із вмістом йонів Са2+ і Mg2+ понад 10 ммоль/л вважається жорсткою. Прикладом м'якої води є дощова вода, жорсткої — вода морів і океанів.
Хімія — це життя: сторінка природодослідника
Завдання. Вивчіть йонний склад двох різних мінеральних вод.
1. Знайдіть на етикетках досліджуваних мінеральних вод інформацію про вміст катіонів та аніонів і заповніть таблицю 11 у робочому зошиті.
Таблиця 11
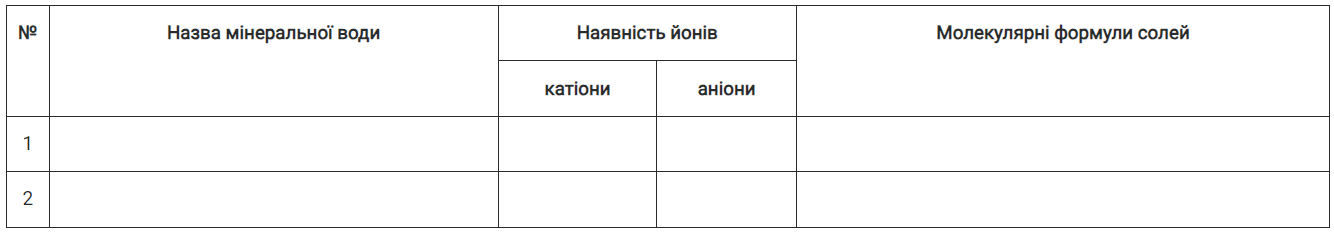
Із зазначених у таблиці катіонів та аніонів складіть хімічні формули солей і запишіть їх в останній колонці таблиці.
2. Запишіть по два катіони та аніони, вміст яких найбільший у складі кожної мінеральної води.
3. Знайдіть на етикетках відомості про загальну мінералізацію води (вміст солей в 1 л) та зробіть висновок, м'якою чи жорсткою вона є.
Розрізняють тимчасову, постійну та загальну жорсткість води (мал. 73).
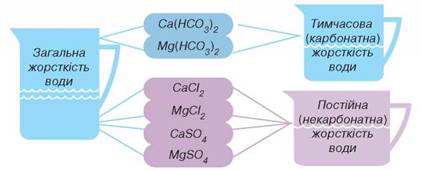
Мал. 73. Види жорсткості води
Зі схеми бачимо, що жорсткість води, зумовлена вмістом у ній кальцій гідрогенкарбонату та магній гідрогенкарбонату, дістала назву тимчасової, або карбонатної.
Враховуючи здатність гідрогенкарбонатів розкладатися під час нагрівання з утворенням нерозчинного у воді кальцій карбонату, тимчасову жорсткість води можна усунути кип'ятінням:
Са(НСО3)2 = СаСО3↓ + Н2О + СО2↑.
Саме ця реакція відбувається під час кип'ятіння води, що має тимчасову жорсткість. Нерозчинні у воді карбонати, що утворюються з гідрогенкарбонатів, осідають на внутрішній поверхні посудин у вигляді білого осаду, утворюючи накип. Якщо вода містить солі Феруму, то накип набуває коричневого відтінку. Накип погіршує процес теплообміну в парових котлах і чайниках, призводить до перевитрат палива і перегрівання металевих поверхонь. З часом чайники, нагрівальні елементи пральних машин (мал. 74) виходять з ладу, просвіти батарей опалення звужуються й тепловіддача погіршується.

Мал. 74. Нагрівальний елемент, вкритий шаром накипу
Крім кип'ятіння, тимчасову жорсткість води усувають хімічним способом, додаючи до води кальцій гідроксид (гашене вапно), натрій гідроксид або соду.
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О
Са(НСО3)2 + 2NaOH = СаСО3↓ + Na2СO3 + 2Н2О
Са(НСО3)2 + Na2CO3 = СаСО3↓ + 2NaHCO3
• Аналогічні реакції для магній гідрогенкарбонату складіть самостійно.
Вивчаючи органічні речовини, ви дізналися про натрій стеариноат C17H35COONa — основну складову твердого мила. Як і всі сполуки Натрію, мило добре розчиняється у воді, а розчин виявляє мийну дію. Однак у жорсткій воді, замість усунення забруднень, мило вступає в реакцію йонного обміну з наявними в ній солями Кальцію чи Магнію, утворюються нерозчинні у воді стеариноати цих металічних елементів:
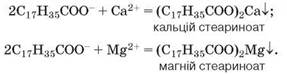
Це їхні «пластівці» з'являються у мильній воді замість густої піни. До того часу, доки всі катіони Кальцію і Магнію не будуть осаджені, мийна дія мила проявляється слабко. Це збільшує витрати мила та погіршує структуру і якість тканин. Синтетичні мийні засоби (пральні порошки, пасти, рідини) не утворюють з Кальцієм та Магнієм нерозчинних солей, а тому забезпечують ефективне прання й економне витрачання мийних засобів як у м'якій, так і в жорсткій воді.
На відміну від гідрогенкарбонатів Кальцію і Магнію, розчинені у воді хлориди і сульфати не можна видалити з розчину кип'ятінням.
Наявність у воді гідрогенкарбонатів Кальцію і Магнію зумовлює тимчасову, або карбонатну жорсткість води.
Наявність у воді сульфатів і хлоридів Кальцію і Магнію зумовлюють постійну, або некарбонатну жорсткість води.
Постійну (некарбонатну) жорсткість води усувають хімічним способом, використовуючи речовини, які переводять йони Кальцію і Магнію з розчину в нерозчинні сполуки. Це можуть бути натрій карбонат (кальцинована сода) Na2CO3, натрій ортофосфат Na3PO4. Як і у випадку з тимчасовою жорсткістю, утворюються нерозчинні карбонати й ортофосфати:
MgSO4+ Na2CO3= MgCO3↓ + Na2SO4;
3CaCl2 + 2Na3PO4 = Са3(РО4)2↓ + 6NaCl.
Перспективним та ефективним способом усунення жорсткості води є йонітний. Для цього користуються йонообмінними колонками (мал. 75). Вони заповнені твердими нерозчинними у воді йонообмінними матеріалами із загальною назвою катіоніти, що містять рухливі йони, наприклад Натрію. Катіони Натрію обмінюються на катіони Кальцію і Магнію, що містяться у жорсткій воді. Унаслідок такого обміну катіони Кальцію та Магнію залишаються в йонообмінній колонці, а пом'якшена вода витікає з неї. Важливо також те, що йонообмінний матеріал піддається регенерації, тобто відновленню.

Мал. 75. Пом'якшення води в лабораторних умовах із використанням йонообмінної колонки
Постійну жорсткість води усувають хімічним способом за допомогою натрій карбонату (кальцинована сода) Na2CO3, натрій ортофосфату Na3PO4, аніони яких утворюють з катіонами Кальцію і Магнію нерозчинні сполуки, або воду пропускають через йонообмінні колонки.
Терміном загальна жорсткість характеризують одночасну присутність у воді сполук, що зумовлюють тимчасову і постійну жорсткість. Якість природних вод характеризують переважно цим терміном, оскільки у більшості випадків природна вода містить і карбонати, і хлориди, і сульфати Кальцію та Магнію.
Про дистиляцію як спосіб отримання м'якої води ви вже знаєте.
Хімія — це життя: сторінка природодослідника
Завдання. У домашніх умовах з поверхні побутових приладів усуньте накип (відклад нерозчинних карбонатів). Для його виконання вам знадобиться: чайник, каструля або інший побутовий посуд, на стінках якого від тривалого кип'ятіння води утворився накип нерозчинних карбонатів; лимонна чи етанова кислоти (оцет), спеціальний засіб для видалення накипу, придбаний у магазині, вода.
Спосіб 1. Усуньте накип з поверхні будь-якого побутового приладу хімічним способом. Для цього приготуйте розчин засобу з розрахунку одна упаковка лимонної кислоти на 3 л води, або 50 мл оцту на такий самий об'єм води. Вилийте виготовлений розчин у посудину так, щоб він повністю покривав поверхню з накипом, закрийте кришкою і кип'ятіть близько 5 хв. Після завершення кип'ятіння зачекайте, поки рідина охолоне (реакція може ще продовжуватись). Вилийте розчин з посудини та ретельно ополосніть її.
Результати проведеного досліду запишіть у робочий зошит, поясніть їх.
Спосіб 2. Якщо маєте змогу придбати один із засобів, призначених для усунення накипу, виконайте дослід, скориставшись ним. Під час виконання досліду чітко дотримуйтесь інструкції, що додається до засобу.
Результати проведеного досліду запишіть у робочий зошит, а також зазначте основну речовину у складі засобу, призначену для зняття накипу.
Сторінка ерудита
Наземним рослинам для живлення, людям і тваринам суходолу для пиття потрібна прісна вода — вода з невеликим вмістом розчинених у ній речовин, які питній воді надають смаку. Водопостачання жителів великих міст здійснюють водою річок і підземними водами. Зокрема, дніпровську воду споживають жителі Києва, Дніпра, Запоріжжя та інших великих міст. Вам відомо, що перш ніж вода з'явиться у квартирах, її очищають і знезаражують, а в спеціальних лабораторіях фахівці з відповідною хіміко-біологічною підготовкою здійснюють контроль якості води. Контроль якості води полягає у встановленні жорсткості води, виявленні відповідності її складу державним нормам. Для цього проводять якісний і кількісний аналіз питної води на вміст у ній катіонів металічних елементів і Гідрогену, аніонів кислотних залишків, шкідливих мікроорганізмів, а також різних органічних речовин, забруднення води якими може статись через недбалу господарську діяльність людей.
Знаємо, розуміємо
- 1. Чим зумовлена жорсткість води? На які види її поділяють?
- 2. Яку загрозу побутовим приладам становить жорстка вода?
- 3. Назвіть солі, що зумовлюють тимчасову жорсткість води.
- 4. Назвіть солі, що зумовлюють постійну жорсткість води.
Застосовуємо
- 1. Поясніть хімічну суть різних видів жорсткості води.
- 2. Складіть рівняння реакцій за схемою перетворень: кальцій карбонат → кальцій оксид → кальцій гідроксид → кальцій гідрогенкарбонат → кальцій карбонат → кальцій хлорид → кальцій нітрат.
- 3. Виконайте завдання з рубрики «Хімія — це життя: сторінка природодослідника». Одержані результати оприлюдніть на уроці.
- 4. Чому вдаються до пом’якшення води, яку використовують у побуті?
- 5*. Запропонуйте спосіб опріснення морської води, який можна було б використовувати в екстремальній ситуації перебування людини у відкритому морі без запасу прісної води.
Коментарі (0)