Особливості взаємодії нітратної та концентрованої сульфатної кислот з металами
- 16-11-2023, 14:06
- 628
11 клас , Хімія 11 клас Савчин (рівень стандарту)
§ 23. ОСОБЛИВОСТІ ВЗАЄМОДІЇ НІТРАТНОЇ ТА КОНЦЕНТРОВАНОЇ СУЛЬФАТНОЇ КИСЛОТ З МЕТАЛАМИ
Опанувавши матеріал параграфа, ви зможете:
- називати продукти взаємодії нітратної та концентрованої сульфатної кислот з металами;
- складати рівняння реакцій нітратної та концентрованої сульфатної кислот з магнієм, цинком і міддю;
- характеризувати специфічні хімічні властивості нітратної та концентрованої сульфатної кислот;
- порівнювати перебіг хімічних реакцій розчинів і концентрованих кислот з металами;
- робити висновки про відмінність хімічних властивостей розчинів і концентрованих кислот.
Особливості взаємодії нітратної кислоти з металами. Під час взаємодії з нітратною кислотою метали не витискають водень. З цією кислотою реагують активні метали й ті, що у витискувальному ряді металів стоять після водню. Залежно від концентрації кислоти, крім солей та води утворюються сполуки Нітрогену. Порівняємо, як відбувається взаємодія міді з концентрованою та розведеною нітратною кислотою (табл. 15).
Таблиця 15
Взаємодія нітратної кислоти з міддю
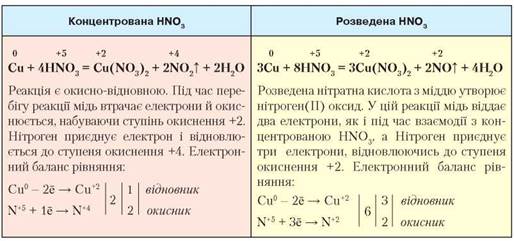
Концентрована нітратна кислота реагує з усіма металами так само, як з міддю. Нітроген відновлюється до ступеня окиснення +4, тобто утворюється нітроген(ІV) оксид. Однак розведена й дуже розведена нітратна кислота по-різному реагує з активними й малоактивними металами. Нітроген відновлюється до різних ступенів окиснення: від -3 до +4 (рис. 40, с. 114).
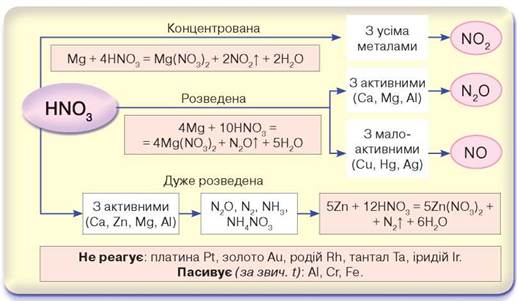
Рис. 40. Схема взаємодії нітратної кислоти різної концентрації з металами
Проаналізувавши рис. 40, дійдемо висновку, що більшість металів реагують з нітратною кислотою. За жодних умов не вступають у хімічну взаємодію платина, золото, родій, тантал та іридій. За звичайних температур (16-25 °С) алюміній, хром і залізо пасивуються під час контакту з нітратною кислотою. Суть процесу пасивування полягає в утворенні на поверхні металів тонких, дуже щільних захисних плівок оксидів алюмінію, хром(ІІІ) і ферум(ІІІ) оксидів, які з холодною нітратною кислотою не реагують.
Складіть самостійно рівняння реакцій взаємодії срібла з концентрованою та розбавленою нітратною кислотою.
Особливості взаємодії сульфатної кислоти з металами. Вам уже відомо, що розведена сульфатна кислота проявляє загальні властивості кислот. Під час таких реакцій Гідроген відновлюється й виділяється як проста речовина водень. Взаємодія концентрованої сульфатної кислоти характеризується тим, що під час цих реакцій відновлюється Сульфур. Концентрована сульфатна кислота реагує з металами, що в ряді активності розташовані до водню, і з тими, що після водню, зокрема міддю, ртуттю та сріблом. З металами, що стоять до водню, залежно від умов, Сульфур відновлюється до ступенів окиснення +4, 0 або -2. Під час взаємодії з міддю, ртуттю та сріблом — тільки до +4 (рис. 41).
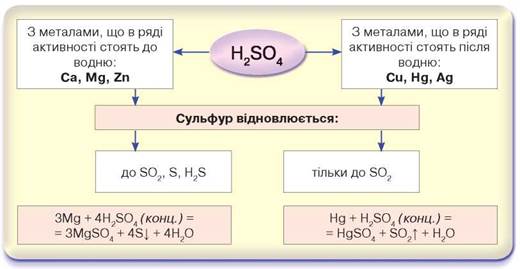
Рис. 41. Схема взаємодії концентрованої сульфатної кислоти з металами
Отже, нітратна й сульфатна кислоти під час взаємодії з металами проявляють специфічні властивості, вони є сильними окисниками. Під час взаємодії нітратної кислоти з металами Нітроген відновлюється до різних ступенів окиснення залежно від концентрації кислоти. Сульфур у концентрованій сульфатній кислоті відновлюється до різних ступенів окиснення залежно від активності металів.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Нітратна й концентрована сульфатна кислоти в реакціях з металами проявляють специфічні властивості: Нітроген і Сульфур, що входять до їхнього складу, є сильними окисниками.
• Концентрована нітратна кислота реагує з усіма металами, крім платини Pt, золота Au, родію Rh, танталу Ta й іридію Ir, відновлюючись до нітроген(IV) оксиду, у якому ступінь окиснення Нітрогену становить +4.
• Розведена нітратна кислота, залежно від активності металу, відновлюється: з активними металами — до нітроген(І) оксиду N2O зі ступенем окиснення +1, а з малоактивними — до нітроген(ІІ) оксиду NO зі ступенем окиснення +2.
• Дуже розведена нітратна кислота реагує з активними металами, відновлюючись до нітроген(І) оксиду N2O, молекулярного азоту N2, амоніаку NH3 або амоній нітрату NH4NO3.
• Концентрована сульфатна кислота як окисник: з активними металами відновлюється до сульфур(IV) оксиду SO2, сірки S, гідроген сульфіду H2S; з малоактивними — тільки до сульфур(IV) оксиду.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Поясніть, як нітратна кислота взаємодіє з металами: а) концентрована з усіма металами; б) розведена з активними й малоактивними металами; в) дуже розведена з активними металами.
- 2. Позначте, до якого ступеня окиснення відновиться Сульфур, і вкажіть формулу сполуки, якщо срібло прореагує з концентрованою сульфатною кислотою.
А +4, SO2
Б 0, S
В -2, H2S
Г тільки +4, SO2
- 3. Укажіть можливі речовини, до яких відновиться Нітроген під час реакції взаємодії магнію з дуже розведеною нітратною кислотою.
А N2, NH3
Б NH3, NO
В N2, NO
Г NH4NO3, NO2
- 4. Складіть рівняння реакцій за схемою: N2 → NO → NO2 → HNO3 → Mg(NO3)2.
- 5. Складіть рівняння реакцій між: а) Ag і HNO3 (конц.); б) Ag і HNO3 (розв.); в) Zn і HNO3 (дуже розв.) з відновленням Нітрогену до ступеня окиснення 0; г) Са і H2SO4 (конц.) з відновленням Сульфуру до ступеня окиснення -2; ґ) Ag і H2SO4 (конц.). Складіть електронний баланс кожного рівняння реакції, укажіть окисник і відновник.
- 6. Мідь масою 1,92 г повністю прореагувала з концентрованою сульфатною кислотою. Обчисліть об'єм газу (н. у.), що виділився. Назвіть газ.
- 7. Алюміній масою 4,32 г повністю прореагував з розведеною нітратною кислотою. Обчисліть масу алюміній нітрату й об'єм газу (н. у.), що утворилися. Назвіть газ.
Коментарі (0)