Гідроген хлорид. Хлоридна кислота
- 29-11-2023, 23:23
- 287
11 клас , Хімія 11 клас Григорович (рівень стандарту)
§ 17. Гідроген хлорид. Хлоридна кислота
Пригадайте:
• реакції обміну відбуваються, якщо в реакції утворюється вода, газувата або нерозчинна речовина;
• амфотерними називають речовини, що виявляють як кислотні, так і основні властивості, до яких належать оксиди та гідроксиди Цинку, Алюмінію тощо.
Фізичні властивості гідроген хлориду і хлоридної кислоти
Гідроген хлорид, або хлороводень:
• безбарвний газ із різким неприємним запахом, важчий за повітря;
• tкип. = 85 °С, tпл. = -114 °С
• отруйний, його вдихання спричиняє кашель, задуху, запалення дихальних шляхів. У разі контакту зі слизовою оболонкою очей може спричинити хімічні опіки;
• один із найбільш розчинних у воді газів: за кімнатної температури в 1 об'ємі води розчиняється близько 450 об'ємів хлороводню;
• взаємодіючи з водяною парою, хлороводень утворює туман.
Якщо товстостінну колбу наповнити гідроген хлоридом і з'єднати її з водою, то як тільки в колбу потрапляють перші краплі води, вони поглинають хлороводень, і вода із силою вривається всередину (мал. 17.1). Якщо заздалегідь додати у воду лакмус, то після потрапляння в колбу він стає червоним.
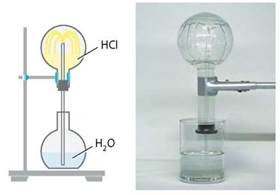
Мал. 17.1. Розчинення хлороводню у воді
Розчин гідроген хлориду у воді називають хлоридною кислотою.
Масова частка гідроген хлориду в насиченому за кімнатної температури розчині становить близько 40 %. Промислові підприємства випускають переважно концентрований розчин, у якому масова частка HCl становить 37 %.

Йоган Рудольф Глаубер (1604-1670)
Відомий німецький алхімік і лікар. Уперше добув хлоридну кислоту
Концентрована хлоридна кислота зазвичай безбарвна рідина, але іноді містить домішки, які надають їй жовтуватого забарвлення.
Хлоридна кислота має запах гідроген хлориду, а на вологому повітрі сильно димить — частково втрачає хлороводень.
Хімічні властивості гідроген хлориду і хлоридної кислоти
1. Електролітична дисоціація. Хлоридна кислота — сильна кислота і у водних розчинах існує у вигляді йонів:
HCl ⇄ H++ Cl-
Цей процес зумовлює те, що хлоридна кислота змінює забарвлення індикаторів та виявляє всі загальні властивості кислот.
2. Взаємодія з активними металами. Метали, що розташовані в ряду активності між натрієм та свинцем, витісняють водень із хлоридної кислоти:
2HCl + Mg = MgCl2 + H2↑
2H+ + Mg0 = Mg2+ + H2↑
Як видно з йонно-молекулярного рівняння, у цій реакції аніони кислотних залишків формально участі не беруть.
Свинець, хоча він і активніший за водень, не взаємодіє з хлоридною кислотою, оскільки під час контакту з нею покривається плівкою нерозчинного хлориду, що перешкоджає реакції.
3. Взаємодія з речовинами, що виявляють основні властивості. Кислоти є хімічними протилежностями основ, тому хлоридна кислота реагує з усіма речовинами, що виявляють основні властивості:
• з основними оксидами: 2HCl + CuО = CuCl2 + H2O;
• з амфотерними оксидами: Al2O3 + 6HCl = 2AlCl3 + 3H2O;
• із лугами: HCl + KOH = KCl2 + 3H2O;
• з амфотерними гідроксидами: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O;
• із нерозчинними основами: Fe(OH)2 + 2HCl = FeCl2 + 2H2O.
В усіх цих реакціях утворюється вода, що є одним із критеріїв можливості перебігу реакцій обміну.
4. Взаємодія із солями. Хлоридна кислота взаємодіє із солями, якщо в результаті реакції утворюється газувата речовина:
2HCl + Na2CO3 = 2NaCl + CO2↑ + H2O
2HCl + FeS = FeCl2 + H2S↑
або нерозчинна у воді речовина:
HCl + AgNO3 = AgCl↓ + HNO3
2HCl + Pb(CH3COO)2 = PbCl2↓ + 2CH3COOH
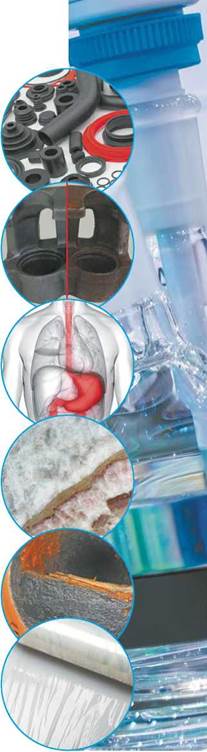
Застосування гідроген хлориду і хлоридної кислоти
Гідроген хлорид та хлоридна кислота — дуже важливі промислові речовини для органічного та неорганічного синтезу.
Гідроген хлорид використовують для одержання хлоропохідних органічних речовин. Із вінілацетилену та гідроген хлориду одержують хлоропрен, що є мономером для виробництва хлоропренового каучуку. Більшу частину гідроген хлориду витрачають на виробництво хлоридної кислоти.
Хлоридну кислоту використовують для травлення сталі — очищення її поверхні від залишків іржі. Після цього метали можна паяти та наносити на їхню поверхню захисне покриття з тонкого шару інших металів. Щоб хлоридна кислота не реагувала з металами, до неї додають інгібітори. Таку кислоту можна зберігати й перевозити в сталевих цистернах.
Дуже розбавлена (0,2-0,5 %) хлоридна кислота міститься в шлунковому соку і сприяє травленню. Хлоридна кислота створює у шлунку кислотне середовище (pH = 1-3), що спричиняє загибель хвороботворних бактерій. У разі недостатньої кислотності шлункового соку лікарі призначають 0,1%-ву хлоридну кислоту.
Геологи використовують хлоридну кислоту для виявлення карбонатних порід і мінералів, наприклад мармуру, завдяки виділенню вуглекислого газу під час взаємодії хлоридної кислоти з карбонатами.
Хлоридною кислотою очищають котли та труби котельних від карбонатного накипу. Також хлоридну кислоту використовують для очищення бурового обладнання, яке забруднюється карбонатними породами в процесі буріння свердловин.
Великі обсяги хлоридної кислоти витрачають для одержання її солей — хлоридів, які також широко застосовують. Зокрема, для добування титан(IV) хлориду TiCl4, одного з компонентів каталізатора Циглера—Натта, без якого сьогодні неможливе виробництво різноманітних полімерів.
Ключова ідея
Хлоридна кислота — одна з найважливіших кислот у різних галузях та є багатотоннажним продуктом хімічної промисловості.
Контрольні запитання
234. Чим відрізняється гідроген хлорид від хлоридної кислоти?
235. Схарактеризуйте фізичні властивості гідроген хлориду та хлоридної кислоти.
Завдання для засвоєння матеріалу
236. Які відмінності дії на іржавий цвях чистої хлоридної кислоти й хлоридної кислоти, що містить інгібітор? Напишіть рівняння реакцій.
237. Як довести, що у складі хлоридної кислоти містяться Гідроген і Хлор? Відповідь підтвердьте рівняннями реакцій.
238. Яку властивість хлоридної кислоти використовують для травлення сталі?
239. Які кристалічні ґратки характерні для твердого гідроген хлориду?
240. Наведіть рівняння реакцій, що характеризують хімічні властивості хлоридної кислоти.
241. Із переліку речовин випишіть ті, з якими взаємодіє хлоридна кислота. Складіть молекулярні та йонно-молекулярні рівняння реакцій.
Ca(OH)2, Zn, CO2, Fe2O3, Hg, Cl2, K2CO3, NaNO3, Pb(NO3)2, Al(OH)3, Cu(OH)2, H2SiO3, FeCO3, MgSO4, Al.
242. Складіть два молекулярні рівняння реакцій, що відповідають йонно-молекулярному рівнянню: Ag+ + Cl- = AgCl↓.
243. Складіть рівняння реакцій для здійснення перетворень за схемами:
а) Cl2 → HCl → KCl → AgCl;
б) CuCl2 → BaCl2 → KCl → PbCl2.
Комплексні завдання
244. Обчисліть відносну густину гідроген хлориду за повітрям.
245. Посудину певного об'єму заповнили гідроген хлоридом та з'єднали її з посудиною, у яку налили воду. Вода повністю заповнила посудину. Обчисліть масову частку хлоридної кислоти в посудині. Молярний об'єм газу за умов досліду дорівнює 24 л/моль.
246. Обчисліть масу хлоридної кислоти з масовою часткою хлороводню 36,5 %, яку можна одержати, використовуючи хлор об'ємом 44,8 м3 (н. у.).
247. За певних умов відносний вихід продукту реакції синтезу гідроген хлориду з простих речовин від теоретично можливого становить 95 %. Обчисліть масу гідроген хлориду, яку можна добути з хлору масою 106,5 кг за цих умов.
Завдання з розвитку критичного мислення
248. Чому гідроген хлорид не можливо одержати взаємодією розчину кухонної солі з розбавленою сульфатною кислотою?
249. За підвищеного тиску гідроген хлорид скраплюється в рідину, що не проводить електричний струм. Чому електричні властивості скрапленого гідроген хлориду та хлоридної кислоти відрізняються?
250. Чи можна збирати гідроген хлорид способом витиснення води, подібно до кисню? Відповідь поясніть.
Міні-проекти
251. Опишіть використання образів чумаків та діяльність щодо добування, транспортування й використання кухонної солі в художніх творах.
Коментарі (0)