Сполуки неметалічних елементів з Гідрогеном
- 15-11-2023, 05:54
- 492
11 клас , Хімія 11 клас Попель, Крикля (рівень стандарту)
§ 18. Сполуки неметалічних елементів з Гідрогеном
Матеріал параграфа допоможе вам:
- з’ясувати склад і назви сполук неметалічних елементів з Гідрогеном;
- порівнювати і пояснювати фізичні властивості цих сполук.
Склад і назви сполук. Сполуки з Гідрогеном відомі для більшості неметалічних елементів; їх не утворюють лише інертні елементи (табл. 6).
Таблиця 6
Формули і назви сполук неметалічних елементів з Гідрогеном1
1 Для Карбону, як вам відомо, існує багато сполук з Гідрогеном; їх загальна назва — вуглеводні.
Скласти формулу сполуки неметалічного елемента з Гідрогеном досить легко. Значення валентності елемента в такій сполуці становить різницю між числом 8 і числом, що дорівнює номеру групи періодичної системи, в якій міститься елемент.
• Визначте ступені окиснення елементів 3-го періоду в їхніх сполуках з Гідрогеном2.
2 Скористайтесь таблицею електронегативності елементів (Додаток 1).
Сполуки неметалічних елементів із Гідрогеном НnЕ, EНn.
Загальна формула сполук елементів з Гідрогеном має два варіанти написання — НnЕ і EНn. Послідовність запису елементів у хімічній формулі кожної сполуки зумовлена традицією: символи елементів VI і VII груп розміщують після символу Гідрогену (H2S), а символи елементів інших груп — перед ним (NH3). Загальні формули сполук неметалічних елементів кожної групи з Гідрогеном указують у деяких варіантах періодичної системи в окремому рядку (форзац І).
Для сполук неметалічних елементів з Гідрогеном частіше використовують тривіальні назви (табл. 6), іноді — хімічні: HF — гідроген фторид, НСl — гідроген хлорид, H2S— гідроген сульфід тощо.
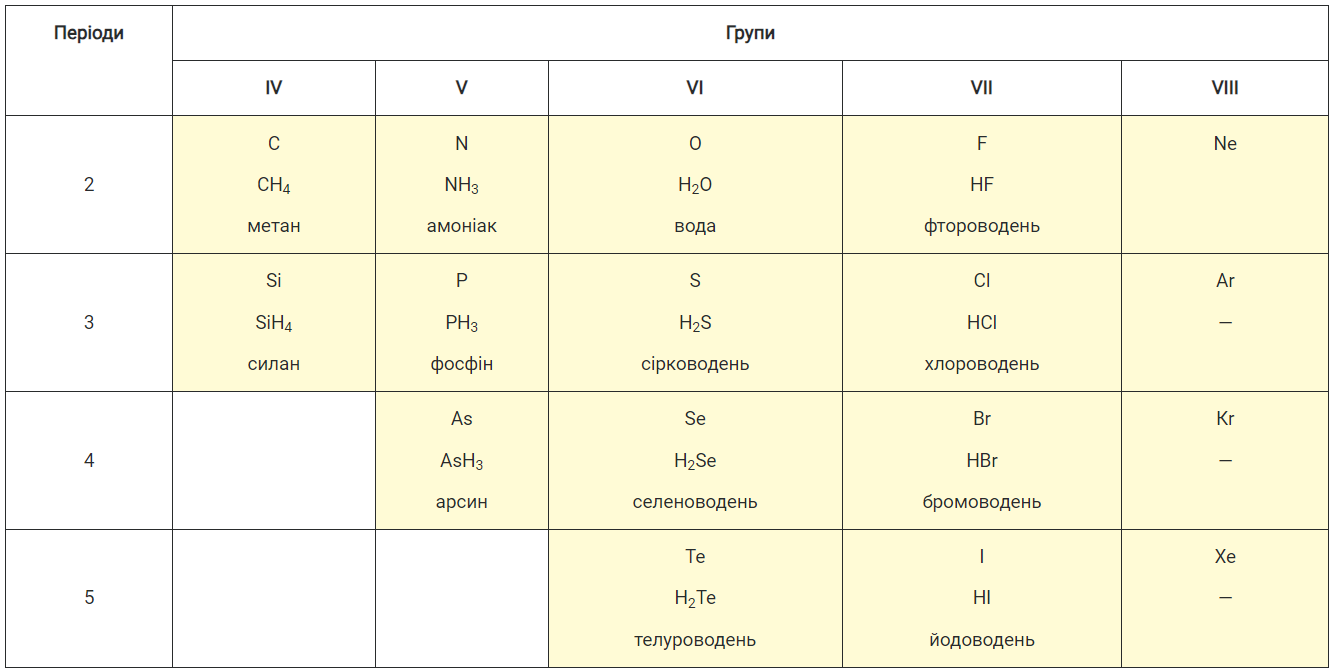
Будова. Сполуки неметалічних елементів з Гідрогеном складаються з молекул (мал. 39); атоми в них сполучені ковалентними зв’язками. Якщо електронегативності елемента і Гідрогену однакові, то ці зв’язки неполярні (наприклад, у молекулі РН3), а якщо різні — зв’язки полярні.
Мал. 39. Масштабні моделі молекул НСІ, H2S, NH3 і СН4
• Зобразіть електронні та графічні формули молекул HF і SiH4. Покажіть у графічних формулах зміщення спільних електронних пар до відповідних атомів.
Якщо позитивні й негативні заряди, що виникли на атомах після зміщення спільних електронних пар, рівномірно розподілені в молекулі, то вона є неполярною (наприклад, молекула СН4). В іншому випадку молекула в одній частині має невеликий негативний заряд, а в протилежній — позитивний заряд. Така молекула полярна; її називають диполем. Полярними є молекули HF, Н2О, NH3 (мал. 39) і деякі інші.
• Доведіть, що молекула води полярна.
Фізичні властивості. Сполуки неметалічних елементів з Гідрогеном, подані в таблиці 6, за звичайних умов1 є газами, а вода — рідиною. Гідроген фторид за температури 19,5 °С переходить із рідкого стану в газуватий. Серед вуглеводнів є гази (сполуки з невеликими відносними молекулярними масами), рідини і тверді речовини.
1 Тобто за температури 20 °С і тиску 760 мм рт. ст.
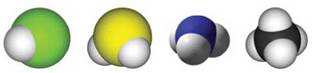
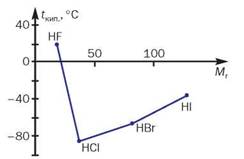
Температури плавлення і кипіння сполук з Гідрогеном елементів кожної групи періодичної системи зростають зі збільшенням відносних молекулярних мас2. Проте сполуки елементів 2-го періоду — вода, амоніак і фтороводень — «випадають» із цієї залежності (мал. 40). Аномально високі температури їх плавлення і кипіння зумовлені існуванням водневих зв’язків між молекулами (мал. 41).
Мал. 40. Залежність температур кипіння сполук елементів VII групи з Гідрогеном від значень їх відносних молекулярних мас
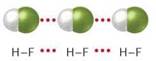
Мал. 41. Водневі зв’язки в рідкому гідроген фториді
2 Вам відома аналогічна залежність для алканів СnН2n+2
Сполуки неметалічних елементів з Гідрогеном безбарвні, деякі мають характерний запах — неприємний, іноді різкий. Багато цих речовин є токсичними.
Найбільшу розчинність у воді мають галогеноводні (сполуки галогенів з Гідрогеном) та амоніак. Наприклад, в 1 л води за нормальних умов (0 °С, 760 мм рт. ст.) розчиняється приблизно 500 л газу хлороводню або майже 1000 л газу амоніаку. Цьому сприяє утворення водневих зв’язків між молекулами води і цих сполук, а також дисоціація молекул галогеноводнів у водному розчині.
Для підтвердження високої розчинності хлороводню у воді й кислотних властивостей водного розчину цієї сполуки демонструють ефектний дослід. У посудину з водою додають кілька крапель розчину лакмусу або метилоранжу. Хлороводнем наповнюють колбу, додають у неї 1—2 краплі води, швидко закривають пробкою, в яку вставлена скляна трубка, і занурюють кінець трубки в посудину з розчином індикатора (мал. 42). Під час розчинення газу тиск у колбі знижується; рідина заповнює колбу, створюючи фонтан, і набуває червоного забарвлення.

Мал. 42. Розчинення хлороводню у воді (дослід «Фонтан»)
Метан дуже слабко розчиняється у воді через неполярність молекул СН4, а отже, неможливість утворення ними водневих зв’язків і нездатність до дисоціації.
ВИСНОВКИ
Майже всі неметалічні елементи, крім інертних, утворюють сполуки з Гідрогеном. Їх загальна формула — НnE або ЕНn. Для цих сполук найчастіше використовують тривіальні назви.
Сполуки неметалічних елементів із Гідрогеном мають молекулярну будову. Галогеноводні та амоніак дуже добре розчиняються у воді.
- 129. Яких значень може набувати індекс n у загальній формулі сполук неметалічних елементів із Гідрогеном?
- 130. Чому галогеноводні мають високу розчинність у воді?
- 131. Хлор і гідроген хлорид істотно різняться за розчинністю у воді. Як це пояснити?
- 132. Чому температура плавлення хлороводню (-114 °С) набагато нижча, ніж натрій хлориду (+801 °С)?
- 133. Внесіть у таблицю відомості про сполуку з формулою НВr (використайте інформацію з інтернету і додаткової літератури):

- 134. Скільки сполук неметалічних елементів з Гідрогеном мають молярну масу 34 г/моль? Напишіть їхні формули.
- 135. Густина галогеноводню за нормальних умов становить 1,63 г/л. Знайдіть за цими даними молярну масу речовини.
- 136. В 1 л води за нормальних умов розчинили 2 л сірководню. Обчисліть масову частку цієї сполуки в розчині, який утворився.
- 137. Сполука елемента X з Гідрогеном містить 2,74 % Гідрогену за масою. Виведіть її формулу.
Коментарі (0)