Ферменти. Регуляція метаболічних шляхів
- 15-09-2021, 22:21
- 1 333
10 Клас , Біологія і екологія 10 клас Задорожний (профільний рівень)
§ 38. Ферменти. Регуляція метаболічних шляхів
Поміркуйте
Досить часто прикріплення невеликої молекули до ферменту на достатньо великій відстані від його активного центру суттєво змінює його активність. На чому ґрунтується це явище?
Згадайте
Каталіз
Ферменти
Метаболізм
Метаболічні шляхи
У клітинах постійно відбувається безліч біохімічних реакцій, що забезпечують обмін речовин. Ці реакції утворюють певні послідовності, в яких продукти одних реакцій стають субстратами для наступних. Сукупність послідовних біохімічних реакцій, завдяки яким відбувається синтез складних сполук з простіших або розпад сполук до кінцевих продуктів, називається метаболічним шляхом. Метаболічні шляхи всіх речовин пов’язані між собою, утворюючи єдину мережу біохімічних реакцій в організмі.
Ферментативний каталіз
Ферментативний каталіз — це прискорення біохімічних реакцій за участю ферментів. Відповідно, ферменти — це біологічні каталізатори, що прискорюють хімічні реакції в живих організмах. Реагенти в реакції, що каталізується ферментами, називаються субстратами, а отримувані речовини — продуктами.
Ферменти зазвичай є білковими макромолекулами. Вони специфічно зв’язують субстрати реакції в особливій ділянці — активному центрі (мал. 38.1). При цьому субстрати орієнтуються так, що набувають оптимального положення для перебігу реакції. Енергія активації, що необхідна для перебігу реакції, при цьому знижується (мал. 38.2).
Загальне рівняння реакції за участю ферменту має вигляд:
![]()
де Ф — фермент, С — субстрат, ФС — фермент-субстратний комплекс, П — продукт реакції
Ферменти є дуже ефективними каталізаторами — швидкість реакцій за ферментативного каталізу збільшується в 109—1012 разів.
Ферменти мають високу специфічність щодо субстратів. Вони каталізують перетворення тільки однієї або декількох близьких за структурою речовин. Специфічність зумовлена просторовою і хімічною структурою ділянки активного центру, що зв’язує субстрат (мал. 38.1).
Коферменти
Коферменти (кофактори) — це низькомолекулярні небілкові речовини, участь яких необхідна для каталітичної дії ферментів. Коферменти приєднуються до активного центру ферменту і беруть участь в утворенні фермент-субстратного комплексу. Коферментами є вітаміни, деякі йони (K+, Mg2+ і Mn2+).

Мал. 38.1. Специфічне зв'язування субстрату зумовлене просторовою будовою й хімічною спорідненістю активного центру ферменту

Мал. 38.2. За умови ферментативного каталізу знижується енергія активації реакції
Регуляція метаболічних шляхів
Швидкість різних метаболічних шляхів регулюється, інакше метаболізм у клітині відбувався б неузгоджено і не відповідав би наявним потребам організму. Найпростіший спосіб регуляції ґрунтується на доступності субстрату: зменшення концентрації субстрату знижує швидкість реакцій, а збільшення концентрації субстрату стимулює метаболічний шлях.
Але основна регуляція здійснюється шляхом зміни концентрації або активності ферментів. Концентрація певного ферменту в клітині регулюється на етапах транскрипції і трансляції, у процесі формування і руйнування ферментного білка. Активність ферменту змінюється за рахунок хімічної модифікації або алостеричної регуляції.
Регуляція транскрипції ферментів
Учені Ф. Жакоб і Ж. Моно сформулювали теорію оперона (1961 р.), що пропонує два механізми регуляції швидкості транскрипції у прокаріотів: індукцію і репресію. Транскрипція регулюється блокуванням або вивільненням оператора — ділянки, з якої починається транскрипція структурного гена. В еукаріотів регуляція ускладнюється і залучає додаткові регуляторні ділянки геному (енхансери, сайленсери), альтернативний сплайсинг та інші механізми.
Алостерична регуляція активності ферментів
Активність ферментів регулюється спеціальними речовинами — інгібіторами (пригнічують активність) і активаторами. Ці речовини зворотно зв’язуються з регуляторним центром молекули ферменту, який просторово віддалений від активного центру. Зв’язування змінює третинну структуру молекули ферменту і, відповідно, структуру активного центру. У результаті змінюється швидкість реакції, що каталізується. Така регуляція має назву алостерична регуляція (мал. 38.3). Активаторами та інгібіторами можуть бути субстрати і продукти реакції.
Алостерична регуляція має дуже важливе значення. Вона зумовлює швидку відповідь клітини на умови, що змінюються, а також регуляцію метаболізму за принципом позитивного і негативного зворотного зв’язку.
Хімічна модифікація ферментів
Інший тип регуляції активності ферментів — їх хімічна модифікація, наприклад фосфорилювання (приєднання фосфатних груп) або глікозилювання (приєднання вуглеводних залишків). Активність ферментів також регулюється шляхом обмеженого протеолізу (видалення фрагменту молекули). Таким шляхом ферменти інактивуються або, навпаки, стають активними.
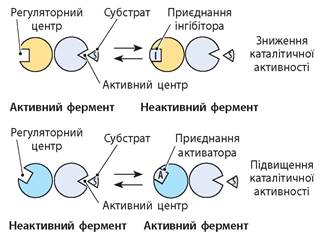
Мал. 38.3. Принцип алостеричної регуляції активності ферменту
Ключова ідея
Хімічні реакції в живих організмах прискорюються ферментами — дуже ефективними і високоспецифічними каталізаторами білкової природи. Швидкість різних метаболічних шляхів регулюється концентрацією субстрату, швидкістю синтезу або розпаду ферментів, зміною активності ферментів (алостерична регуляція, хімічна модифікація).
Практична робота
Вивчення активності ферментів слини
1. Виконайте дослід із взаємодії розчинів слини (ферменту амілаза) і крохмалю за умови:
а) різної температури;
б) різної кислотності (pH) середовища.
2. Сформулюйте висновок.
Запитання та завдання
1. Що є коферментом гемоглобіну? хлорофілу? 2. Які фактори (зовнішні, генетичні та інші) можуть порушити правильну регуляцію метаболічного шляху? 3. Що може статися, якщо порушиться регуляція певного метаболічного шляху?
Коментарі (0)